단축키
Prev이전 문서
Next다음 문서
단축키
Prev이전 문서
Next다음 문서
헬리코박터 파일로리(Helicobacter pylori) 는 만성 위축성 위염, 위 장화생, 이형성증 및 선암종을 유발하는 1급 발암물질입니다. H. pylori가 다른 위험 및 보호 요인, 특히 위암 발생 시 비타민 C와 상호작용하는 메커니즘은 복잡합니다. 위암 발생에는 대사, 환경, 후성 유전, 게놈, 감염, 염증 및 발암 경로가 포함됩니다. 위암 아형의 분자 분류는 위암 발병에 대한 이해에 혁명을 일으켰습니다. 여기에는 종양 미세환경, 생식계열 돌연변이, 헬리코박터 파일로리 박테리아, 엡스타인 바 바이러스 및 체세포 돌연변이에서의 후생유전학의 역할이 포함됩니다. 아스코르브산, 식물화학물질 및 내인성 항산화 시스템이 위암의 위험을 조절할 수 있다는 증거가 있습니다. 위액 아스코르브산염 수준은 아스코르브산의 식이 섭취에 따라 다르지만 H. pylori 감염, H. pylori CagA 분비, 담배 흡연, 무위산증 및 만성 위축성 위염에 의해 감소될 수도 있습니다. 아스코르빈산은 위 세포 보호의 항산화 효과, 활성 비타민 E 및 글루타티온 재생, 내인성 N-니트로소화 억제, 섭취된 니트로소디메틸아민 및 헤테로사이클릭 아민의 독성 효과 감소, H. pylori 감염 예방을 통해 위암을 예방할 수 있습니다 . 이러한 세포 보호의 효과는 H. pylori 균주 독성, 특히 CagA 발현과 관련이 있습니다. 위암의 후생적 재프로그래밍에서 비타민 C의 역할은 여전히 진화하고 있습니다. 비타민 C와 관련된 다른 요인들도 위암 발생에 중요한 역할을 합니다. H. pylori 의 박멸은 위 상피에 의한 비타민 C 분비의 회복으로 이어질 수 있으며 전암성 위 병변의 퇴행을 가능하게 하여 위암 발생의 Correa 폭포를 방해할 수 있습니다.
1. 소개
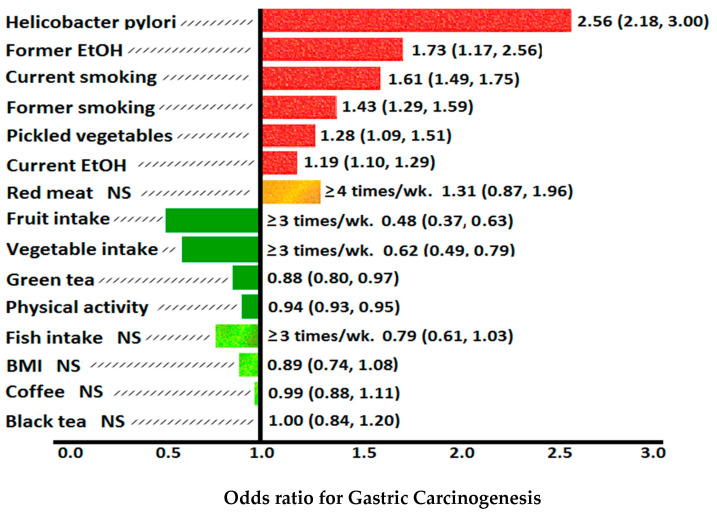
2018년 글로벌 암 통계(GLOBOCAN 2018)는 2018년에 전 세계에서 1,033,701명의 새로운 위암 사례가 발생하고 782,685명이 사망한 것으로 추정했습니다[ 1 ]. 이는 폐암 다음으로 전 세계적으로 암 관련 사망의 두 번째 주요 원인을 나타내며 간세포/담관암종이 그 뒤를 바짝 뒤따르고 있습니다[ 1 , 2 , 3 , 4 , 5 ]. 위암 발생률은 전 세계적으로 지리적으로 뚜렷한 차이가 있으며, 동아시아 국가에서 발생률이 가장 높고 북미와 북아프리카에서 발생률이 가장 낮습니다[ 1 , 2 ]. 이는 헬리코박터 파일로리(Helicobacter pylori) 유병률, 균주 독성 및 추가적인 위암 위험 요인 과 관련이 있는 것으로 생각됩니다 [ 2 , 3 , 4 ].
위암의 경로는 대사, 환경, 후성 유전, 게놈, 감염성, 염증성 및 발암성을 포함하여 복잡하고 상호 연관되어 있습니다. 여기에는 헬리코박터 파일로리 박테리아 또는 엡스타인 바 바이러스(EBV) 감염, 위축성 위염(AG), 위 장화생(IM), 식이 요법, 고염분 섭취, 흡연, 음주, 비만, 인종 배경, ABO 혈액 과 같은 위험 요소가 포함 됩니다. 위암의 그룹, 생물학적 성별 및 가족력 [ 6 ]. 1994년 세계보건기구(WHO)와 국제암연구소는 H. pylori를 1급 발암물질로 분류했습니다[ 7 ].
이 검토에서는 H. pylori , 담배 흡연, 니트로사민, 헤테로고리 아민, 식이 소금 및 알코올 소비와 같은 식이 및 환경 위험 요인의 역할을 포함하여 위암에 대한 분자 경로에 대한 심층 분석을 제공합니다 . 위 세포 보호, H. pylori 독성, 후성 유전학 및 위 종양 사이의 상호 관계 도 조사됩니다. 여기에는 위암 발병에 있어 내인성 항산화 시스템, 비타민 C(아스코르브산) 및 기타 섭취된 식물화학물질의 잠재적인 보호 효과가 포함됩니다.
2. 위암 발생
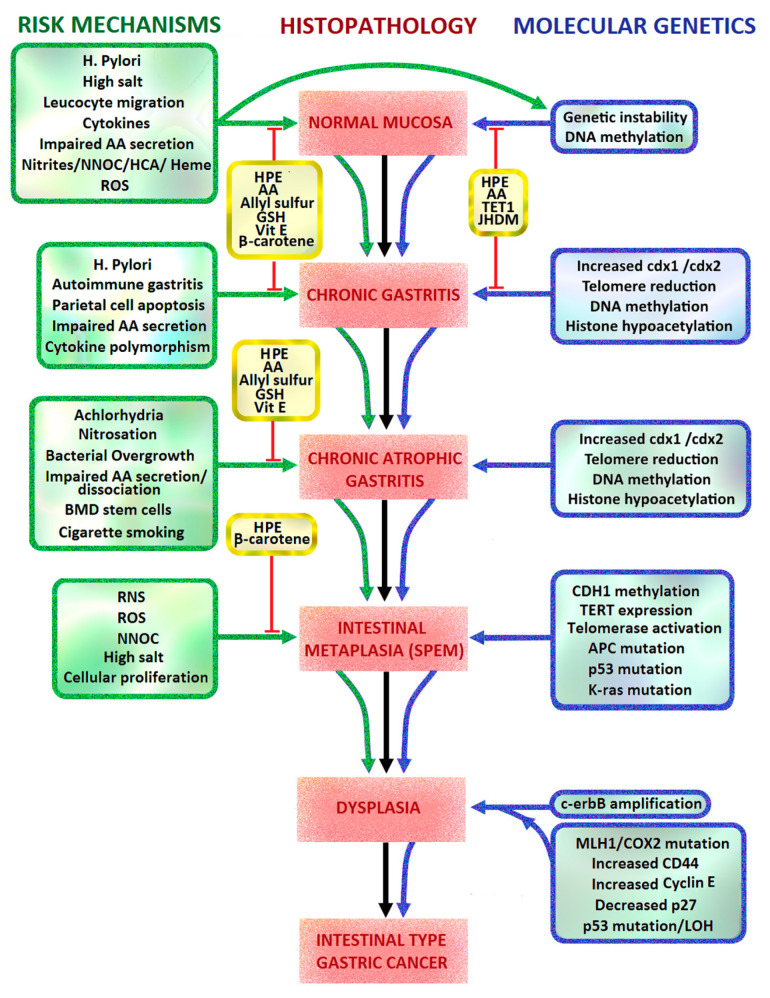
2.1. 장화생의 Correa Pathway 및 시드니 분류
비심장성 위암 중 89%는 H. pylori 세균 감염과 관련이 있고 9%는 EBV와 관련이 있습니다. 장형 위암 발생의 Correa 모델은 다발성 AG, IM, 저등급 이형성증, 고등급 이형성증 및 최종적으로 위 선암종으로 진행되는 만성 활동성 위염의 다단계 캐스케이드입니다[ 8 ]. 수정된 시드니 시스템(Modified Sydney System)은 국제적으로 인정받는 만성 위염 분류의 내시경 및 조직학적 시스템으로, 1994년에 처음 도입되었습니다. 이 시스템에는 비정상적인 위 점막의 표적 내시경 생검과 위 유합부, 절치부 및 체부의 비표적 생검이 포함됩니다. 이는 위 IM, AG 및 이형성증의 감지율을 높이고 매핑 생검을 통해 향후 내시경 감시를 안내할 수 있습니다. 유럽위장내시경학회 가이드라인에는 현재 H. pylori 환자에 대한 제균치료 와 위 IM이 발견된 환자에 대해 3년마다 내시경 감시를 포함하고 있다[ 9 ].
위 장화생은 국소적인 분포와 광범위한 분포, 그리고 완전하거나 불완전한 조직학적 외관으로 분류됩니다. 완전 위 IM에는 위 점액(MUC1, MUC5AC 및 MUC6)이 손실된 소장 샘, 브러시 테두리가 있는 호산구성 장세포, 잘 정의된 술잔 세포 및 가끔 파네스 세포가 있습니다. 불완전 위 IM에는 세포질 내 점액 방울이 있고 흡수성 브러쉬 경계가 없는 결장형 샘이 포함되어 있습니다. 불완전 IM은 증식률이 더 높으며 광범위한 IM과 함께 완전 IM에 비해 장형 위암 위험이 4~11배 더 높습니다[ 9 , 10 , 11 ].
장형 위암과 IM은 높은 수준의 꼬리형 호메오박스-2(CDX-2) 발현을 특징으로 하며, 이는 산발성 미만성 위암(DGC)에서도 발현되지만 정상 위 상피와 상염색체 우성 유전성 위암에서는 발현되지 않습니다. HDGC) [ 12 , 13 ]. DGC는 장형 위암에서 AG와 IM의 중간 단계 없이 만성 활동성 위염에서 직접 발생하는 것으로 보입니다. DGC는 핵을 세포 주변으로 옮기는 세포내 점액 액포로 인해 조직병리학적으로 반지 세포 모양이 나타나는 응집력이 약한 선암종 세포를 특징으로 합니다[ 10 ].
2.2. 헬리코박터 파일로리
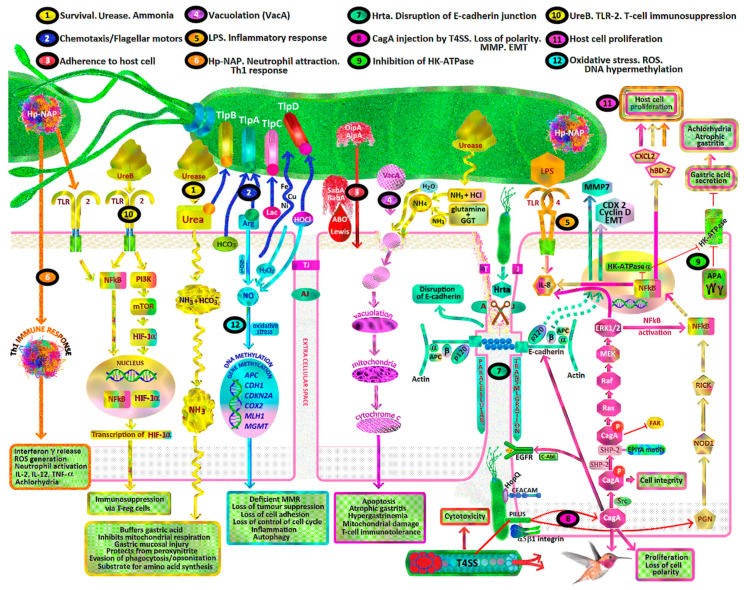
헬리코박터 파일로리(Helicobacter pylori) 는 최초로 기술된 세균성 발암물질입니다. 이는 일반적으로 어린 시절에 획득되며 장기간의 집락화 및 만성 위염으로 인해 결국 비심장성 장형 위선암종, 산발성 미만성 위암 또는 위 B세포 림프구 점막 관련 림프 조직(MALT) 림프종으로 이어집니다[ 14 ]. H. pylori 독소 에 노출되면 위 산화 스트레스, 반응성 알데히드 형성, 세포 DNA 및 RNA 손상, DNA 프로모터 유전자의 과메틸화, 숙주 염증 반응, 만성 점막 염증, 무위산증, 다른 발암 물질과의 시너지 상호 작용 및 항산화 보호 실패가 발생합니다. 위 점막에서. 이러한 메커니즘에는 다음이 포함됩니다.
-
위점막 상피세포를 손상시켜 만성 위축성 위염, 아스코르브산의 위점막 분비 감소, 벽세포 사멸, 무위증, 고가스트린혈증, 위세균 불균형, 장화생, 이형성증 및 장형 위암을 유발하는 H. pylori 독소(그림 1, 경로 1, 4, 8, 9).
-
급성 및/또는 만성 염증을 유발하는 염증 세포 모집, 호중구 미엘로페록시다제-차아염소산염(HOCl)-과산화수소(H 2 O 2 ), 대식세포 산화질소(NO) 및 상피 세포 수소를 포함한 활성 산소종(ROS) 경로의 활성화 과산화물 생산 (그림 1, 경로 6, 12).
-
반응성 질소종(RNS), ROS, 지질 과산화 및 MDA/자유 라디칼 형성으로 인한 산화 스트레스는 위 항산화 보호를 압도합니다.
-
H. pylori CagA, VacA, BabA, SabA, Hp-NAP, ROS, RNS, 우레아제, DNA 과메틸화 및 세포 티로신 키나제를 포함한 다양한 메커니즘을 통해 위 상피 증식, 종양 유전자 및 DNA 손상 촉진 (그림 1, 경로 1, 3, 4, 7, 8, 10, 11, 12).
-
티로신 키나제 발암 경로의 조절 장애 및 종양 억제 인자(p53, CDH1/E-cadherin, APC, MGMT, MLH1, CDKN2A)의 손실로 인해 세포사멸 및 상피 중간엽 전이(EMT) 실패로 이어짐그림 1, 경로 7, 8).
-
섭취한 발암 물질(니트로사민/헤테로고리형 아민/아질산염/식염/알코올/담배 연기)과의 시너지 효과 및 항산화제와의 복잡한 상호 작용으로 인해 보호 효과가 감소되고 발암이 촉진됩니다(그림 1).
2.3. 위암 역학
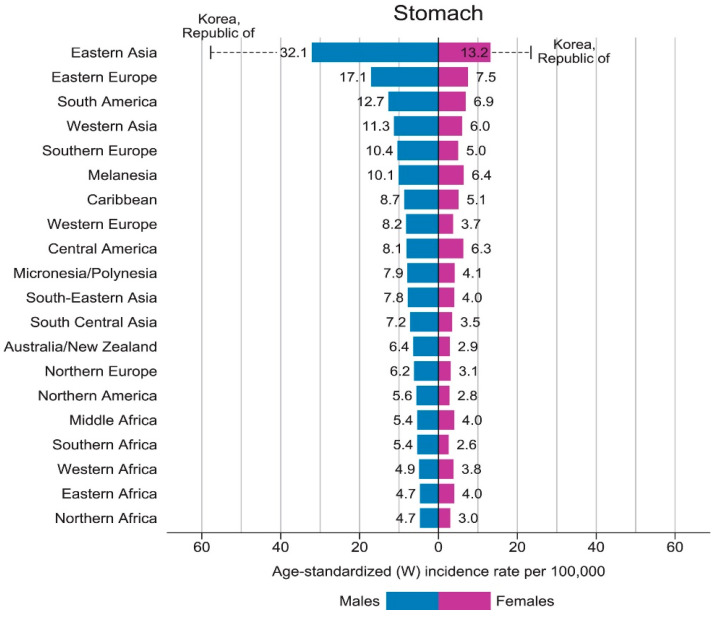
세계 인구의 최소 절반이 H. pylori 에 감염되어 있지만, H. pylori 에 걸린 사람 중 0.2~3%만이 위암에 걸립니다. GLOBOCAN 2018 데이터에 따르면 동아시아 국가(남성 32.1/10 5 명, 여성 13.2/10 5 명), 동유럽 국가(남성 17.1/10 5명 , 여성 7.5/10 5 명) 에서 위선암종 발생률이 3~12배 더 높습니다. H. pylori 의 독성 계통이 풍토병인 안데스 라틴 아메리카(남성 26.9/10 5명 , 여성 10.3/10 5 명) . 이는 호주/뉴질랜드(남성 6.4/10 5 , 여성 2.9/10 5 ), 북아프리카(남성 4.7/10 5 , 여성 3.0/10 5 ) 및 북미(5.6/10 5) 에서 발생률이 가장 낮은 지역과 비교됩니다. 남성, 2.8/10 5 여성). 위암 발생률이 가장 높은 곳은 한국이며, 전국 발병률은 남성이 60/10 5명 , 여성이 25/10 5명 입니다 [ 1 ] (그림 2). 서구 선진국에서 비심장성 위암 및 소화성 궤양 질환의 발병률 감소는 이들 국가, 특히 65세 미만의 사람에서 H. pylori 집락화 발병률 감소와 병행하여 발생했습니다[ 15 ]. H. pylori는 구강-구강 및 대변-구강 경로를 통해 전달되어 가족 내에서 세대 간 확산으로 이어집니다. 개발도상국에서 H. pylori 의 유병률은 사회 경제적 지위와 밀접한 관련이 있습니다. 영양 부족, 인구 과밀, 부적절한 위생 및 긴밀한 개인 접촉으로 인해 정착률이 증가하기 때문입니다[ 16 ].
2.4. 로렌 분류
1965년 Lauren 분류가 도입된 이후 위암은 장암, 미만성 또는 혼합/불확정 조직학적 아형으로 분류되었습니다. 남성은 여성보다 장형 비심장성 위암으로 진단될 확률이 2~4배 더 높은 반면, DGC는 여성에서 더 흔합니다[ 14 ]. H. pylori 는 비심장성 위선암종의 주요 위험 요소이며 신선한 과일과 채소가 풍부한 식단이 보호 요소로 간주됩니다[ 17 , 18 ]. 미만성 위암과 장형 위암 모두 H. pylori 감염을 비롯한 일부 식이 및 환경 위험 요인은 물론 DNA 메틸화, 히스톤 메틸화, 아세틸화, 염색체 재조합 등의 분자 이상을 공유합니다. 장형 비심장성 위암(OR = 4.45, 95% CI: 2.74~7.24)과 DGC(OR = 3.39, 95% CI: 1.70~6.76)를 유발하는 H. pylori 의 비교 위험도 는 동일했습니다( p = 0.50). 1228건의 위암 사례와 3406건의 대조군을 포함하는 12개 연구에 대한 통합 메타 분석에서[ 19 , 20 ].
유전적 소인은 40%의 사례에서 E-cadherin( CDH1 ) 유전자 생식계열 돌연변이 로 인해 HDGC에서 더 흔합니다 . HDGC는 전체 위암 사례의 1~3%만을 차지합니다. 이는 상염색체 우성 유전이 특징이며 DGC의 평생 위험도가 70%와 관련이 있습니다[ 12 , 21 ]. 위암 발생의 '2 히트' 이론은 두 번째 CDH1 대립유전자의 상실(메틸화, 체세포 돌연변이 또는 이형접합성 상실에 의한)이 E-카데린 당단백질 발현 감소 및 DGC 발달에 필요함을 시사합니다. 산발성 DGC는 35~55%의 사례에서 CDH1 프로모터 유전자 의 과메틸화와 관련이 있습니다 . DGC에서 발견되는 다른 유전자 돌연변이에는 Ras 동족체 유전자 계열, 구성원 A(RhoA), claudin-18 및 Rho GTPase 활성화 단백질 6(CLDN18-ARHGAP6) 및 TGFβR1 의 돌연변이가 포함됩니다 [ 12 , 21 ].
장형 비심장성 위암은 남성 환자(남:F = 1.8:1), 노인 환자(남성 평균 연령 = 50.4세, 여성 평균 연령 = 47.7세)에 영향을 미치고 림프관 및 혈관 침범을 통해 전이되는 경향이 있으며 관련 질환이 있습니다. 미만성 아형에 비해 임상 경과가 길고 예후가 좋습니다. 미만성 위암은 위체에서 발생하는 경향이 있고, 젊은 환자, 특히 여성에게 영향을 미치며, 위 점막하층과 고유근층의 미만성 침범 및 그에 따른 복막 전이를 선호합니다. 혈액형 A는 DGC와도 연관되어 있습니다[ 19 , 20 ].
2.5. 위암 분자 아형
2014년에 Cancer Genome Atlas Research Network는 위암종을 4가지 주요 분자 하위 유형으로 분류했습니다. 여기에는 다음이 포함됩니다.
-
DNA 프로모터의 과메틸화와 관련된 Epstein Barr 바이러스(EBV, 8.8%). EBV 위암은 특징적으로 위 근위부에서 발견됩니다. 이는 조직학적으로 림프구 침윤, PD-L1 및 PD-L2 과발현 및 CDKN2A 침묵을 보이는 저분화 선암종입니다[ 22 ].
-
주로 hMLH1 유전자 프로모터의 돌연변이로 인한 현미부수체 불안정성(MSI, 21.7%)은 DNA 불일치 복구(dMMR)의 결핍으로 이어집니다. MSI는 린치 증후군, 원위 위암 및 조직학상의 로렌 장 하위 유형과 관련이 있습니다.
-
장형 암 및 시토신 및 구아닌(CpG) 섬 메틸화 표현형(CIMP)에 따른 염색체 불안정성(CIN, 49.8%). CIN 위암은 위식도접합부와 위분문에서 더 자주 발생합니다(65%).
-
DGC를 사용하면 게놈적으로 안정합니다(GS, 19.7%)[ 23 ].
후속 전사체 및 단백질체학 분석을 통해 위암은 상당한 종양 내, 환자 내 및 환자 간 가변성을 갖는 복잡하고 이질적인 질병이라는 것이 입증되었습니다[ 24 , 25 , 26 ]. Lei 분류(2013)는 위암을 증식성, 대사성 및 중간엽 하위 유형으로 나누는 생물학적, 치료적으로 의미 있는 분류입니다. 2015년 아시아암연구회(ACRG)에서는 위암 300건의 mRNA 발현을 분석했다. 분자 하위 유형은 다음과 같이 분류되었습니다.
-
MSI 높음(23%),
-
미세부수체 안정/상피 중간엽 전이(MSS/EMT, 15%),
-
미세위성 안정/TP53 온전함(MSS/TP53+, p53 활성, 26%)
-
미세위성 안정/TP53 손실(MSS/TP53−, p53 비활성, 36%).
-
각 하위 유형은 뚜렷한 치료 옵션 및 예후 결과와 연관되어 있습니다 [ 27 ].
2.6. Cardia 대 비 Cardia 위암
H. pylori는 비심장 선암종(OR = 2.97; 95% CI: 2.34–3.77)과 비교하여 위 심장 선암종(OR = 0.99; 95% CI: 0.72–1.35)에 대한 유의한 위험 인자가 아닌 것으로 보입니다. [ 19 ]. 숙주 감수성, 유전체학, 환경 발암 물질, 조직 보호 메커니즘, 산화환원 상태 및 후생유전학 간의 상호 작용이 두 그룹 모두에서 위암 발생의 진행을 결정하는 것으로 보입니다. 그러나 악성 H. pylori 균주(즉, CagA+, VacA s1+)에 의한 감염은 비심장형 위암에서 가장 중요한 위험 요소입니다[ 6 ].
2.7. 위 산화 스트레스
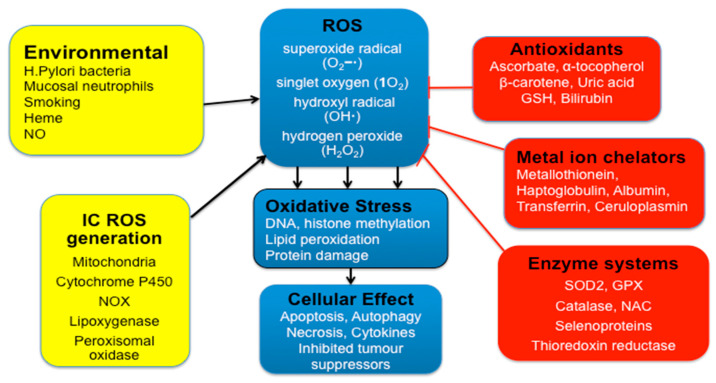
생물 반응기인 위장은 섭취된 발암 물질과 반응성 종, 박테리아 병원체 및 음식 소화와 관련된 산화 화합물에 지속적으로 노출됩니다 [ 28 ]. 위 세포 보호 및 산화 스트레스 예방은 온전한 내인성 항산화 시스템과 섭취된 항산화제 및 식품 내 식물화학물질에 달려 있습니다[ 29 ]. 과산화물, 과산화수소 및 퍼옥실과 같은 ROS는 세포막 지질에서 전자를 훔쳐 지질 과산화 및 불안정한 지방산 라디칼(지질 과산화수소)의 형성을 초래할 수 있습니다 [ 30 ]. 이들은 분해되어 위에서 글리옥살, 메틸글리옥살, 아크롤레인, 4-하이드록시노네날 및 말론디알데히드(MDA)와 같은 세포 독성 케톤, 에폭사이드 및 반응성 알데히드를 생성합니다. 그런 다음 이들은 장에서 흡수되어 혈장 및 소변 수치가 상승합니다. 반응성 알데히드는 단백질과 DNA를 손상시키고, 말론디알데히드-데옥시구아노신과 같은 DNA 부가물을 형성하며, 또한 저밀도 지질단백질(LDL)과 반응하여 MDA-LDL을 형성합니다[ 29 ]. 반응성 알데히드(예: MDA)에 의한 고급 지질 과산화 최종 산물(ALE) 및 고급 당화 최종 산물(AGE)의 생성은 박테리아 및 포유류 시스템에서 돌연변이를 유발하고 쥐에서 발암성을 일으키는 것으로 나타났습니다[ 29 , 31 ] (그림 3). AGE와 수용체(RAGE)의 상호작용은 위암의 진행을 촉진합니다[ 32 ].
2.8. 위 세포 보호
위 세포 보호는 다음을 포함한 항산화 시스템에 의존합니다.
-
슈퍼옥사이드 디스뮤타제(SOD), 카탈라제(CAT), 티오레독신 환원효소 및 글루타티온 퍼옥시다제(GPX)와 같은 효소 항산화제.
-
α-토코페롤(비타민 E), 아스코르브산(비타민 C), 베타카로틴, 빌리루빈, 글루타티온(GSH) 및 요산과 같은 소분자 항산화제.
-
메탈로티오네인, 합토글로불린, 알부민, 트랜스페린 및 세룰로플라스민을 포함한 금속 이온 킬레이트제(그림 3).
이는 ROS 형성과 자유 라디칼 손상을 방지합니다. 셀레늄은 글루타티온 퍼옥시다제(GPX1-GPX4 및 GPX6), 티오레독신 환원효소(TXNRD1-2) 및 티오레독신-글루타티온 환원효소(TXNRD3)를 포함하는 셀레노단백질 항산화 효소 계열의 중요한 구성 요소입니다. 셀레노단백질은 세포질에서 과산화수소(H 2 O 2 )를 빠르게 제거할 수 있는 독특한 특성을 가지고 있습니다. 이는 H 2 O 2 가 철과 반응하여 산소 유래 자유 라디칼 중 가장 반응성이 높은 수산기 라디칼을 형성하는 것을 방지합니다. 따라서 셀레늄 결핍은 산화 스트레스와 염증 강화에 기여합니다 [ 33 ].
비타민 C는 위 점막/관강 표면의 산화 스트레스를 감소시키는 데 중요합니다. 또한 요산염, 글루타티온, 베타카로틴, α-토코페롤(비타민 E)을 재생하여 항산화 방어 시스템을 유지합니다. 글루타티온은 산화된 비타민 E(토코페릴 라디칼) 또는 산화된 비타민 C(데히드로아스코르브산, DHA)를 재생하여 이 과정에서 티오닐 라디칼(GS)을 생성할 수 있습니다[ 34 ]. 비타민 C는 초생리학적 수준에서 또는 펜톤 화학에 의해 수산기 라디칼이 생성되는 철이나 구리와 같은 전이 금속 이온의 존재 하에서 산화촉진제 역할을 할 수 있습니다. 예를 들어, 고용량 경구용 아스코르브산은 섭취한 붉은 고기(헴 철)에 산화 촉진 효과가 있어 위에서 지질 과산화를 일으킬 수 있습니다. 그러나 아스코르브산이 폴리페놀(예: 카테킨)과 결합하면 시너지적인 항산화 효과가 있으며 지질 과산화가 방지됩니다. 세이지나 로즈마리에 함유된 폴리페놀은 붉은 고기의 위에서 ALE 형성을 최대 100% 억제할 수 있습니다. 개별 경구용 항산화 보충제가 대규모 인간 예방 연구에서 왜 성공하지 못할 수 있는지에 대한 이론 중 하나는 식이 폴리페놀이나 셀레늄의 광범위한 결핍입니다. 그러나 지중해식 식단과 같이 식물성 폴리페놀 과 비타민C가 풍부한 식단은 식사 중 위에서 산화환원 항상성을 유지하는 데 도움이 됩니다[ 29 , 35 ].
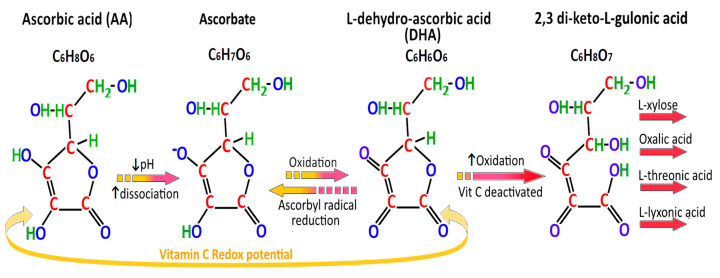
신선한 감귤류의 중요성은 1747년 HMS 솔즈베리호 에서 해군 외과의사 제임스 린드(James Lind) 박사 가 선원들이 괴혈병을 치료할 때 하루에 오렌지 2개와 레몬 1개를 섭취하는 모습을 보여주면서 입증되었습니다[ 36 ]. 그 이후로 콜라겐 형성에서 비타민 C의 중요한 역할이 확립되었으며 비타민 C의 결핍으로 인해 Fe 2+ /2-옥소글루타레이트(2-OG) 의존성 디옥시게나 제 프롤릴 수산화효소에 의해 아미노산 프롤린이 수산화프롤린으로 수산화가 손상됩니다 . 이러한 산화환원 능력은 또한 비타민 C를 인간 혈청과 조직에서 주요하고 필수적인 수용성 항산화제로 만듭니다. 비타민 C는 중간체 아스코르빌 라디칼을 통해 DHA를 형성하는 전자 공여체 역할을 할 수 있습니다. 따라서 비타민C는 과산화물 음이온 라디칼(O 2 − · ), 일중항 산소(1O 2 ), 하이드록실 라디칼(OH · )을 제거하고 차아염소산(HOCl)을 중화시키며 지질 과산화를 방지할 수 있습니다. 비타민 C는 과산화수소(H 2 O 2 )를 제거하거나 중화할 수 없습니다. 오히려 비타민C는 카탈라아제 활성을 억제하여 독성을 강화할 수 있습니다. HOCl은 호중구에 존재하는 골수과산화효소(MPO)에 의해 H 2 O 2 와 Cl - 로부터 생성됩니다. [ 37 , 38 ] (그림 3그리고그림 4).
비타민 C는 CIMP 및 8-하이드록시-2-데옥시구아노신(8-OHdG) 형성을 포함한 산화제 매개 손상으로부터 DNA를 보호할 수 있습니다. 식세포 유래 산화제를 중화시켜 산화제 매개 기능 불활성화로부터 1-프로테아제 억제제(API)를 보호하는 것으로 보고되었습니다. 비타민 C는 비타민 E 재생을 통해 세포막, 미토콘드리아, 소포체와 같은 지용성 환경의 항산화 보호에도 중요합니다. 이는 비타민 E 라디칼에 전자를 기증하여 비타민 E의 활성 형태를 재생함으로써 그렇게 합니다. , 알파-토코페롤 [ 34 ]. H. pylori가 생성한 말론디알데히드-데옥시구아노신 에 대한 비타민 C의 예방 효과에 대해서는 논쟁이 있습니다[ 29 , 31 , 39 ].
2.9. 아스코르브산의 흡수와 분비
인간은 다른 고등 영장류, 과일박쥐, 기니피그와 마찬가지로 포도당 에서 아스코르빈산을 내생적으로 합성하는 마지막 단계를 촉매하는 효소인 기능성 간 L-굴로노-감마-락톤 산화효소(L-GULO) 가 없습니다. . 따라서 이러한 특정 포유동물은 경구 비타민 C 섭취가 부적절할 경우 괴혈병(및 산화 스트레스)의 위험이 있습니다. 따라서 식이 비타민 C 섭취량, 비타민 C 수송체 및 산화 스트레스 수준이 아스코르브산의 혈장 및 기관 수준을 결정합니다. 미국 식품영양위원회에서는 남성의 비타민 C 일일 권장량(RDA)이 90mg, 여성의 경우 75mg입니다. 인간의 정상적인 혈장 비타민 C 수준은 30~90μmol/L이며, 한계 결핍은 11~23μmol/L이고 결핍은 <11μmol/L입니다. 비타민 C는 두 개의 나트륨 의존성 비타민 C 수송체(SVCT1 및 SVCT2)를 통해 장에서 활발하게 흡수됩니다. DHA는 소장에서 촉진 확산을 통해 흡수되며 장세포 포도당 운반체(GLUT2, GLUT8)에 의한 능동 수송을 위해 포도당과 경쟁합니다. 장세포(및 적혈구)에는 DHA를 아스코르베이트로 전환하여 낮은 세포 내 DHA 수준과 지속적인 DHA 흡수를 위한 농도 구배를 유지하는 GSH 의존성 탈수소아스코르베이트 환원효소가 포함되어 있습니다[ 41 ]. 비타민 C 신장 역치는 혈장 농도 80μmol/L 이상에서 발생합니다[ 41 ].
비타민 C는 가스트린, 콜레시스토키닌 (CCK) 및 아세틸 콜린의 영향을 받아 위 상피 세포에 의해 위강으로 활발하게 분비 됩니다 . 갭 접합 반채널, Ca 2+ 의존성 음이온 채널, 세포막 동종 및 이종 교환 시스템 또는 분비 소포를 함유한 아스코르베이트의 세포외유출을 포함하여 비타민 C 분비에 대한 다양한 메커니즘이 제안되었습니다 [ 43 ].
아스코르빈산 수치는 일반적으로 인간의 혈장보다 위샘에서 3~10배 더 높습니다. 위선의 아스코르브산 축적은 위 상피의 기저외막에 위치한 SVCT2에 의한 8배 농도 구배에 대해 발생합니다. KATO III 및 AGS 위 상피 세포의 아스코르브산 수준 분석은 Km이 3–11 μmol/L인 아스코르브산에 대한 높은 친화력, 포화 수송 시스템을 보여주었습니다. 위 내강 아스코르베이트의 농도는 H. pylori 감염, 경구 비타민 C 섭취 부족, 양성자 펌프 억제제 사용, 흡연, 위 점막의 분비 장애, 자가면역 위염, 무위산증 및 위축성 위염에 의해 감소됩니다. 경구 비타민 C의 평균 섭취량은 H. pylori 음성 대상자의 130.9mg/일에 비해 H. pylori 양성 대상자( 35.9mg/일) 에서 더 낮은 것으로 나타났으며 ( p < 0.01), 이는 또한 위내 감소에 기여할 수 있습니다. 아스코르베이트 수준 [ 41 ].
내강 위 아스코르베이트가 가역적 생성물인 DHA와 비가역적 생성물인 2,3-diketo-L-gulonic acid로 산화되는 것은 H. pylori 관련 위염 의 pH 증가와 관련이 있습니다 . 정상 위 pH가 pH < 2 인 H. pylori 양성 환자의 평균 위액 아스코르브산 수치는 16.5μmol/L였지만, 위 pH가 2~4인 환자에서는 4.5μmol/L로 떨어졌고, 위 pH가 2~4인 환자에서는 0으로 떨어졌습니다. 위 pH > 6 [ 44 ]. 고양이, 토끼, 개, 염소, 쥐 및 생쥐와 같은 다른 포유동물은 L-GULO 기능을 보존했으며 산화 스트레스 동안 비타민 C 합성을 현저하게 증가시킬 수 있습니다[ 45 , 46 ] (그림 4).
3. 헬리코박터 파일로리(Helicobacter pylori) - 위암 발병 요인 및 경로
3.1. 헬리코박터 파일로리
H. pylori 는 전 세계 인구의 절반을 감염시키는 미호기성 그람 음성, 편모형 곡선 막대입니다. 편모 운동성, 주화성 신호 전달, 우레아제 활성, 암모니아 생성, 박테리아 독소 및 부착 분자에 의해 인간 위의 산성(내강 pH = 1.2-3.5) 환경에서 살도록 진화했습니다. 일단 섭취되면 H. pylori 박테리아는 4-8개의 단극 편모로 헤엄치고 점성 위 점액을 암모니아로 소화하여 위의 두꺼운 점액층(100μm)을 관통합니다. 나선형 모양은 코르크 따개 모양의 시계 반대 방향 회전 운동으로 점액층에 침투할 수도 있습니다. 암모니아는 요소를 암모니아와 CO2 가스로 분해하는 H. pylori 우레아제 활성 과 글루타민 을 암모니아로 가수분해하는 H. pylori 유래 γ-글루타밀 트랜스펩티다제(GGT)에서 유래합니다[ 47 ].
3.2. H. pylori 우레아제
H. pylori 우레아제 효소는 처음에는 세포질 내에 존재하지만, 위 군집화가 시작된 후에는 표면과 결합될 수 있습니다. 또한 분비나 세균의 자가분해에 의해 세포외 공간으로 방출될 수도 있습니다. 우레아제 아포효소는 세포질의 히스티딘 키나아제에 의해 조립되며 두 개의 주요 하위 단위인 UreA와 UreB로 구성됩니다. 그런 다음 12각형 우레아제 복합체는 보조 단백질인 UreE/UreG 및 UreF/UreH에 의해 성숙되고 두 개의 니켈 이온(Ni 2+ ) 의 삽입에 의해 활성화됩니다 . 숙주 유래 요소가 박테리아 세포질의 요소분해효소에 도달하려면 H. pylori 외막과 내막을 모두 통과해야 합니다 . 이 과정은 내부 막(UreI)에 있는 특정 양성자 개폐 요소 공극에 의해 촉진됩니다. 요소는 요소분해효소에 의해 두 분자의 암모니아(2NH3)와 탄산(H2CO3)으로 가수분해되고 , 탄산 은 세포질 의 β- 탄산 탈수효소에 의해 CO2 가스 로 전환된다 . 그러면 UreI는 주변세포질을 통해 암모니아와 CO 2 의 역이동을 가능하게 합니다. 주변세포질/내부 막에 위치한 α-탄산 탈수효소는 주변세포질 완충을 위해 되돌아오는 CO 2 로부터 HCO 3 - 를 생성할 수 있습니다 [ 48 , 49 ]. NH 4 + /NH3 (pKa = 9.3) 및 HCO 3 - /CO 2 완충 위벽 세포 유래 HCl은 즉각적인 외부 환경뿐만 아니라 박테리아 세포질 및 주변세포질에도 존재합니다. 이러한 메커니즘에 의해 H. pylori 세포질 pH는 외부 pH(pH e )가 2.5만큼 낮더라도 상대적으로 중성 및 주변세포질 pH를 약 6.1로 유지합니다. 이는 H. pylori 세포 내 항상성을 유지하고 위장의 성공적인 박테리아 정착을 허용합니다. ureAB 의 전사는 산과 니켈에 의해 유도됩니다[ 50 ]. H. pylori 우레아제 활성은 외부 pH(pH e )가 감소함에 따라 기하급수적으로 증가합니다. 즉, pH e < 4 에서 요소의 가용성이 위에서 H. pylori 생존을 결정합니다[ 51 ] (그림 1, 경로 1). 숙주 유래 요소가 제한된 조건에서 H. pylori 아르기나제는 내인적으로 l-아르기닌으로부터 요소와 l-오르니틴을 생산할 수 있습니다[ 52 ].
3.3. H. pylori 유래 암모니아
기체인 암모니아는 지질막을 통해 쉽게 확산되고 반응하여 막 내부에서 OH - 및 NH 4 +를 형성합니다. 이는 세포내 소기관의 내부 pH를 상승시켜 점막 대식세포의 식세포-리소좀 융합과 상피 세포 미토콘드리아의 기능에 영향을 미칠 수 있습니다. H. pylori 양성 대상자 의 위액에는 H. pylori 음성 대상자 의 위액(<0.005%)보다 훨씬 더 높은 농도의 암모니아(0.01~0.02%)가 포함되어 있습니다 . H. pylori 양성 대상자 의 위액 내 암모니아 수준은 다음과 같은 결과를 가져올 수 있습니다.
-
완충 위산
-
위 상피 미토콘드리아 및 분리된 세포 호흡을 억제합니다.
-
위 상피 세포에 세포 독성을 유발합니다.
-
위점막 손상에 기여
-
H. pylori가 숙주의 식세포작용과 옵소닌화를 회피할 수 있도록 합니다 .
-
숙주가 생성한 퍼옥시니트라이트로부터 H. pylori를 보호합니다.
3.4. H. pylori 및 저염소증
초기 H. pylori 감염 후 3일 이내에 발생하는 급성 및 중증 저산소증의 다른 메커니즘은 다음과 같습니다.
-
위 양성자 펌프(H + /K + -ATPase) 활성을 억제하는 인터루킨-1β(점막 호중구 및 단핵구에서)의 T 헬퍼 유형 1(Th1) 세포 분비 증가 (그림 1, 경로 6).
-
양성자 펌프 H + /K + -ATPase를 억제하고 두정 세포 분비 소포에서 양성자(H + ) 수송을 소멸시키는 H. pylori 지방산(테트라데칸산 및 시스 9,10-메틸렌옥타데칸산) 의 방출 [ 54 ].
-
Enterochromaffin 세포 히스타민 분비 및 antral G 세포 가스트린 분비의 신경 억제에 의한 산 분비 억제 [ 56 ].
-
H. pylori VacA는 세뇨관(H + /K + -ATPase 함유 )이 위벽 세포 꼭대기 막으로 결합되는 것을 방해합니다[ 54 ].
어린이의 급성 저염소수증 또는 "유행성 저염소수증"은 1910년 William Osler 경에 의해 처음 기술되었습니다. 이는 초기 H. pylori 감염 중에 발생하지만 정수리 세포의 손실로 인한 것은 아닙니다. 정수리 세포 손실은 보상성 G 세포 증식 및 고가스트린혈증과 함께 확립된 H. pylori 유발 만성 위축성 위염 에서만 나중에 발생합니다 . H. pylori 관련 만성 위축성(체) 위염 에서 정수리 세포 사멸의 기전에는 Th1 사이토카인(TNF-α, IL-1β), IL-17A 사이토카인-리간드 유도 카스파제 활성화와 관련된 Th17 면역 반응 및 항 정수리 세포 항체가 포함됩니다. (APA) 세대 [ 57 ].
3.5. H. pylori와 주화성
화학주성은 H. pylori 유기체가 틈새를 찾고 위장의 적대적인 환경에서 생존하는 데 필수적입니다 . 산도, 중탄산염, 요소, 에너지, 아미노산(아르기닌, 글루타민, 히스티딘) 및 전이 금속(철, 아연, 구리, 니켈)에 대한 화학주성은 H. pylori 화학 감지 및 편모 모터 스위치를 통해 발생합니다. 따라서 H. pylori는 위의 미세 환경에서 이러한 물질을 감지하고 산성 지역에서 멀리 영양분을 향해 헤엄칠 수 있습니다. 네 가지 알려진 H. pylori 화학수용체 또는 변환기 유사 단백질(Tlp) 이 있으며 , 그 중 3개는 막 국소화되어 있고(TlpA, TlpB, TlpC), 1개(TlpD)는 전적으로 세포질입니다[ 50 , 51 , 52 , 53 , 54 , 55 , 56 ].
-
TlpA는 위 점막 아르기닌/아미노산, 산성 pH 및 중탄산염을 감지할 수 있습니다.
-
TlpB는 요소 및 박테리아 정족수를 감지합니다(자가 유도제(AI-2)를 통해)
-
TlpC는 젖산염을 감지합니다.
-
TlpD는 ROS, 알칼리성 pH, 호중구 유래 HOCl 및 전자 수송 억제제를 감지합니다.그림 1, 경로 2).
화학수용체와 편모 회전으로 인해 H. pylori는 섭취 후 14시간 이내에 전정부 및 체점막샘에 신속하고 우선적으로 군집을 형성할 수 있을 뿐만 아니라 영양분을 더 많이 이용할 수 있는 손상된 위 상피 및 호중구 활동 영역에도 서식할 수 있습니다. H. pylori는 전정부에 위치한 LGR5+ 성체 줄기 세포를 포함하여 주화성을 통해 특정 위 상피 세포 유형을 표적으로 삼는 것으로 보입니다. 위 점액 아래 위샘의 군집화에 대한 이러한 선호는 상피 중탄산염 배설에 의한 완충으로 인해 위샘의 더 높은 pH와 관련이 있습니다. 위산도 수준을 변환하고 pH가 낮은 영역(위 내강)에서 반발하고 중탄산염(위선)으로 끌어당김으로써 H. pylori는 생존할 수 있는 반면, Salmonella 및 Vibrio spp. 와 같은 다른 장내 세균 병원체는 생존할 수 있습니다 . [ 58 , 59 ]할 수 없습니다. 위산을 분비하는 위를 섭취하고 군집화한 후, 대부분의 H. pylori는 전정부 점액의 처음 15μm에서 수영하는 것으로 발견되며, H. pylori 박테리아의 30%는 전정부에 인접한 점액의 1~5μm에서 발견됩니다. 상피. H. pylori 의 약 2%만이 상피 세포에 부착됩니다. 위 점액의 중간 부분이나 관강 부분에는 무시할 수 있는 숫자가 있습니다. AG 또는 PPI 사용으로 유발된 만성 무위산증 상태에서 H. pylori 박테리아는 위체 및 저부를 포함하여 위에 더 광범위하게 서식할 수 있습니다[ 60 , 61 , 62 , 63 , 64 ] (그림 1).
3.6. H. pylori 우레아제의 비효소적 효과
H. pylori 우레아제는 효소 활성에 개별적이고 독립적인 영향을 미치는 독성 인자입니다. 세포외 UreB는 상피 세포 수용체 CD74(MHCII)에 결합할 수 있으며, 이는 생존 유전자와 염증 경로를 활성화합니다. 여기에는 다음이 포함됩니다.
-
단핵구와 호중구를 포함한 염증 세포의 케모카인인 IL-8의 방출
-
NF-κB 전 염증 경로의 활성화
-
일차 점막 대식세포의 활성화
-
위 상피 세포 Th1 사이토카인(IL-1β, IL-6, TNF-α, IL-8) 방출
-
위 상피 밀착 접합의 파괴
-
비장 림프구에 의한 IL-4 방출 및 항체 생산
-
혈소판 응집 [ 53 ].
UreB는 또한 H. pylori 지질다당류(LPS) 결합 과 무관한 위 상피 꼭대기 막의 TLR-2 수용체에 결합합니다 . 이는 NF-κB 및 PI3K/AKT/mTOR/HIF-1α 경로를 모두 활성화합니다. 정상 산소 상태에서 UreB에 의한 위 상피 HIF-1α의 유도는 Cyclin D1을 통한 세포 순환과 Treg 세포를 통한 면역 내성에 영향을 미치며 HIF-1α(LDH, VEGF, GLUT1)의 일반적인 표준 전사 표적을 포함하지 않는 것으로 보입니다. [ 48 ] (그림 1, 경로 10).
3.7. HIF의 H. pylori 유도
헬리코박터 위염 과 관련된 활성 산소종 축적 및 비타민 C 결핍은 HIF-1α의 정상산소 안정화를 위한 추가 메커니즘입니다. 이는 아스코르베이트가 HIF-α 프롤릴 수산화효소 계열(PHD)의 활성에 필요한 보조효소이기 때문입니다. 특정 HIF-α 프롤린 잔기는 HIF-α-PHD에 의해 수산화되어 von Hippel-Lindau 단백질(pVHL)-elonginB-elonginC(VBC) 복합체에 대한 HIF-1α 펩타이드의 친화성을 증가시킵니다. HIF-1α는 VBC 복합체에 의해 유비퀴네이트화되고 26S 프로테아좀에 의해 분해됩니다. 정상적인 생리학적 조건에서는 최소한의 세포 HIF-1α가 존재합니다. 그러나 저산소증, ROS 또는 숙신산염 축적, HSP 활성화, 미토콘드리아 기능 장애, 비타민 C 또는 철분 결핍 하에서는 PHD2가 억제됩니다. 따라서 HIF-1α는 안정화되어 세포질 내에 축적됩니다. HIF-1α는 핵으로 이동하여 HIF-β와 결합하여 HIF 이종이합체를 형성합니다. HIF는 증식(Caveolin-1, CTGF, IGFBP3, MET), 혈관 신생(EPO, PDGFβ, VEGF), 산화환원 항상성(GPX3, HMOX1, SOD2), 포도당 수송을 포함한 저산소증 반응 요소(HRE)의 전사 표적을 활성화합니다. 대사(GLUT, HKII, LDHA, PDK1, PGK1, PKM2), 상피 중간엽 전이(SNAIL, SLUG, VM, ZEB), 전이 및 침윤(CXCL12, CXCR4, LOX, MMP1, MUC-1, S100A4, TWIST1) 38 , 65 ].
3.8. H. pylori 및 Correa 경로
1892년 이탈리아의 병리학자인 Guilio Bizzozero는 개의 위점막에 존재하는 나선형 박테리아를 관찰한 것을 보고했습니다. 그의 발견은 박테리아가 위의 산성 환경에서 생존할 수 없다는 널리 퍼진 믿음 때문에 대부분 무시되었습니다 [ 66 ]. 1975년 팔레요 코레아(Paleyo Correa)는 원래 장형 위암의 조직학적 경로를 제안했습니다. 1984년 Marshall과 Warren이 H. pylori를 재발견 하고 Correa 등이 추가 연구를 수행한 후 그는 양성 위험 요소( H. pylori 감염, 식이 소금, N-니트로소 화합물)와 음성 위험 요소(비타민 C, β- 1992년에 위암에 대한 카로틴)이 이 경로로 진입했습니다. [ 6 ] (그림 5). H. pylori 박테리아는 1994년 WHO에 의해 위암에 대한 1급 발암물질로 분류되었습니다[ 7 ]. 위암 발생에서 H. pylori 의 역할에 대한 많은 증거는 풍토병 지역의 역학 연구에서 비롯됩니다.
예를 들어, Uemura et al. 등은 등록 당시 십이지장 궤양, 위궤양, 위 증식 또는 비궤양성 소화불량을 앓고 있던 1526명의 일본 환자를 대상으로 전향적 연구를 수행했습니다[ 67 ]. 평균 7.8년의 추적관찰 후에 H. pylori 양성 환자의 2.9%(36/1246)와 H. pylori 음성 환자 의 0%(0/280)에서 위암이 발생했습니다. 위암은 다음에서 발생합니다.
-
비궤양성 소화불량 환자 445명 중 21명(4.7%, p <0.001),
-
위궤양이 있는 297명 중 10명(3.4%, p =0.002),
-
위 증식성 폴립이 있는 229명 중 5명(2.2%, p = 0.02),
-
십이지장 궤양이 있는 275명 중 0명.
향후 위암 발병과 관련된 초기 내시경 검사 이상에는 중증 위위축(RR = 4.9), 범위염(RR = 15.6), 체우세위염(RR = 34.5) 및 장상화생(RR = 6.4)이 포함되었습니다[ 67 ]. 십이지장 궤양 환자는 체구 보존, 위산 분비가 높은 전정부 특이 헬리코박터 위염을 보이는 반면, 위궤양 및 위암 환자는 공복 시 저산소증, 낮은 펩시노겐 I 수준(70ng/mL) 및 펩시노겐 I/II 비율(<3)을 나타냅니다. 및 중증의 코퍼스 우세 위축성 위염 [ 68 , 69 ]. Eslicket al. H. pylori가 위암 발병 위험을 2배 증가시키는 것으로 나타났습니다 [ 70 ]. 이는 유럽의 암 및 영양에 대한 전향적 조사(EPIC)-EURGAST 연구의 결과와 상관관계가 있습니다[ 71 ].
3.9. H. pylori 유발 염증 반응
H. pylori는 우레아제, 프로테아제, 포스포리파제, 펩티도글리칸, 암모니아, Hp-NAP, VacA, CagA, BabA, SabA, GGT 및 아세트알데히드를 생성하여 위 점막 손상을 유발합니다. 또한 숙주 염증 반응을 시작하여 활성 산소종, 활성 질소종 및 산화질소 합성효소(NOS)를 생성합니다[ 72 ]. 여기에는 종양 괴사 인자 세포사멸 유도 리간드(TRAIL), IL-1 수용체 관련 키나제(IRAK-1)의 인산화 및 NF-κB 활성화에 의해 유발되는 심각한 숙주 염증 반응이 포함됩니다[ 73 ]. H. pylori 감염 에 대한 염증 반응의 규모는 숙주 사이토카인 발현의 다형성에 의해 증가하며, IL1RN, IL1β-511 및 TNFA-308 유전자형은 무염증 , 만성 위축성 위염, 장상화생 및 위암과 더 밀접하게 연관되어 있습니다 . (그림 5).
3.10. H. pylori와 ROS
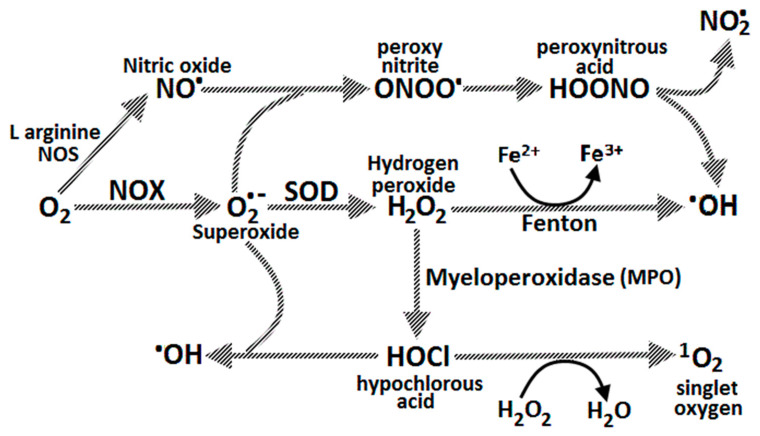
H. pylori 의 악성 균주가 위장에 정착 되면 Helicobacter pylori 호중구 활성화 단백질(Hp-NAP)과 케모카인 방출(IL-8)이 호중구, 대식세포 및 T 림프구의 위 점막으로의 이동을 촉진합니다. 이는 추가 염증, ROS 형성의 호흡 파열, 점막 손상, DNA 손상, 정수리 세포 사멸 및 잠재적인 위암 발생을 유도합니다. DNA는 ROS에 의한 탈 퓨린화, 탈아미노화, 메틸화 또는 산화로 인해 손상될 수 있습니다 . H. pylori 에 의한 위점막 호중구로부터의 ROS 방출 유도는 S. aureus 나 E. coli 보다 10배 더 큽니다 [ 75 ]. 호중구가 생성하는 4가지 산화제는 NO · , O 2 −· , H 2 O 2 및 HOCl이며, 이들은 서로 상호작용하여 과산화질산염(ONOO − )과 수산기 라디칼(OH · )을 형성합니다. HOCl은 포자 및 비포자 형성 박테리아를 포함한 대부분의 인간 병원성 유기체를 효과적으로 죽이는 물질입니다. 그러나 위 점막에 부착된 H. pylori 유기체에 대해 호중구와 대식세포가 방출하는 산화 분자는 상피 세포에 부수적인 손상을 일으킵니다.그림 1통로 6,그림 6).
처음에 O 2 −·는 박테리아 병원체의 식세포작용에 반응하여 세포성 NADPH-옥시다제(NOX)에 의해 생성되고, 이는 이후 세포외 공간으로 방출되어 슈퍼옥사이드 디스뮤타제(SOD)에 의해 H 2 O 2 로 전환됩니다 . H 2 O 2 는 막을 통해 쉽게 확산되며 펜톤 반응에 의해 OH · 를 형성할 수 있습니다. 호중구 미엘로페록시다제는 생성된 H 2 O 2 의 대부분을 사용하여 Cl − + H 2 O 2 →HOCl + OH − 반응을 촉매합니다 . HOCl은 또한 O 2 −· 와 반응하여 수산기 라디칼을 형성할 수 있습니다. NO(iNOS에 의해 아르기닌과 산소로부터 생성됨)는 O 2 −· 와 반응하여 퍼옥시니트라이트를 형성할 수 있으며, 이는 이후 OH · 및 NO 2 · 형성을 생성합니다. OH · 과산화질산염은 물론 포유동물 세포의 DNA 염기 손상의 상당 부분을 유발합니다. HOCl은 피리미딘 산화 생성물, DNA-단백질 교차 결합 및 DNA 염기(예: 5-클로로우라실)의 염소화와 같은 DNA 손상을 일으키는 것으로 알려져 있습니다. [ 76 , 77 ] (그림 1통로 12,그림 6). H. pylori 단백질 및 DNA 에 대한 숙주 염증 세포 유래 ROS 손상을 피하기 위해 H. pylori 박테리아는 집락화 후 DNA 및 단백질 복구 효소와 최소 14가지 항산화 단백질(예: 카탈라제, SOD, 티오레독신 환원효소)을 발현합니다.
3.11. H. pylori와 면역감시 회피
H. pylori 지질다당류 내독소 지질 A는 숙주 양이온성 항균 펩타이드에 저항하고 Toll-like 수용체 4(TLR-4) 인식을 회피하도록 변형될 수 있습니다.그림 1, 경로 5). 인간 루이스 항원을 모방하는 H. pylori 지질다당류 의 O-항원에 포함된 푸코실화 올리고당도 있습니다 . 이는 H. pylori 의 숙주 T 세포 면역감시 회피와 지속적인 위 군체 형성을 돕습니다. 이러한 루이스 유형 항원의 발현은 H. pylori 에 의해 광범위하게 다양하여 다양한 위 숙주 환경에 적응할 수 있습니다[ 78 ]. 인간 열 충격 단백질 60(Hsp60)과 H. pylori Hsp60 사이에도 유사성이 존재하여 항-Hsp60 자가항체가 생성됩니다. 이는 미만성 위암 및 B세포 림프구 점막 관련 림프 조직(MALT) 림프종과 관련이 있습니다[ 79 ].
3.12. H. pylori와 DNA 손상
H. pylori는 위에서 만성 산화 스트레스와 MDA 형성을 유발하여 단일 및 이중 DNA 가닥 절단, DNA 복구 실패 및 DNA 부가물을 유발합니다[ 80 , 81 ]. DNA 부가물에는 8-히드록시데옥시구아노신, 티민 글리콜 및 5-히드록시메틸 우라실이 포함되며, 이는 그 자체로 DNA 메틸화, 일반적인 돌연변이, 후생적 변화를 일으키고 위암 발생에 기여할 수 있습니다 [ 75 ].
3.13. H. pylori, iNOS, ROS 및 DNA 과메틸화
유도성 산화질소 신타제(iNOS)는 아미노산 아르기닌으로부터 NO를 합성하는 효소입니다. NOS는 H. pylori 감염 에 의해 위점막과 호중구에서 유도될 수 있으며 , 그 결과 국소 NO가 크게 증가합니다. 산화질소는 O 2 −· 및 금속과 반응하여 퍼옥시니트라이트를 형성하며 이는 상피 유래 H 2 O 2 와 함께 DNA 산화 부가물을 생성할 수 있습니다. NO는 또한 8-옥소구아닌 글리코실라제에 의한 DNA 복구를 방해합니다. H. pylori 와 관련된 산화 스트레스는 CpG 섬 프로모터 유전자의 과메틸화와 DNA 메틸트랜스퍼라제의 활성 증가를 통해 종양 유전자를 활성화하고 종양 억제 유전자를 비활성화합니다[ 14 ]. Dinget al. (2010)은 H. pylori 에 의해 유도되는 다중 발암 경로를 설명했습니다 . 여기에는 변형에 의한 NF-κB, 활성인자 단백질-1(AP-1), PI3K, 베타-카테닌, E-카드헤린( CDH-1 ), Runt 관련 전사 인자 3( RUNX3 ) 및 사이클로옥시게나제 2( COX-2 )가 포함됩니다. 염색질 단백질과 DNA 메틸화로 인해 상피 증식과 위암이 발생합니다 [ 82 ]. H. pylori 유발 메틸화 에 의해 영향을 받는 다른 프로모터 유전자에는 다음이 포함됩니다.
-
DNA 복구 [O-6-메틸구아닌 DNA 메틸트랜스퍼라제 효소(MGMT)],
-
DNA 불일치 복구 [MutL 동족체 1( MLH1 )],
-
세포주기 [사이클린 의존성 키나제 억제제 2A( CDKN2A )],
-
염증 [세포일 인자 2( TFF-2 )],
-
전사 인자 [Forkhead Box D3( FOXD3 ), 업스트림 자극 인자( USF1 및 USF2 ), GATA4 ],
-
자가포식( ATG16L1 ),
3.14. H. pylori, NF-κB, STAT3, TNF-α, 비타민 C 및 β-카로틴
비타민 C는 NF-κB 및 STAT3의 H. pylori 매개 활성화를 억제 하고 표피 성장 인자(EGF) 유사 및 두 개의 폴리스타틴 모티프 2(TMEFF2)로 막횡단 단백질을 상향 조절하여 시험관 내에서 AGS 세포의 종양 억제를 촉진하는 것으로 나타났습니다. ; 및 미토콘드리아 매개 경로에 의한 AGS 세포사멸 [ 84 ]. 시험관 내 연구에서는 β-카로틴이 항산화 활성을 통해 H. pylori 유도 NF-κB 활성화 및 AGS 세포의 ROS 수준을 감소시켜 종양 괴사 인자 수용체 관련 인자(TRAF) 유도 위 상피 과다증식을 억제하는 것으로 나타났습니다. ROS 생성의 감소는 NADPH 산화효소의 β-카로틴 억제에 의해 매개되었습니다. β-카로틴은 H. pylori 에 의해 유도된 IκBα의 분해를 차단하여 세포질에 NF-κB를 유지하여 핵 전좌 및 TRAF1 및 TRAF2 유전자 발현을 포함한 핵 전사 표적의 활성화를 방지할 수 있었습니다 . 임상 예방 연구에 따르면 β-카로틴을 경구 섭취하면 H. pylori 발병 지역 에서 위암 위험이 48%까지 감소할 수 있는 것으로 나타났습니다[ 85 ].
4. 헬리코박터 CagA+/VacA+
4.1. CagA+/VacA+
H. pylori는 지리적으로 7개의 개별 개체군과 하위 개체군으로 분포되어 있습니다. 동아시아 H. pylori 균주는 유럽이나 아프리카 균주에 비해 세포독소 관련 유전자 A(CagA) 및 공포 독소 A(VacA) 발현이 다르기 때문에 병원성이 더 높습니다[ 86 , 87 ]. cag-PAI의 전파는 hpEastAsia 및 hpAfrica1 계통에서 거의 보편적으로 존재하는 것부터 중간 존재(hpEurope)를 거쳐 완전한 부재(hpAfrica2)까지 다양합니다[ 86 , 87 ]. VacA 및 CagA 양성은 위암의 승산비를 두 배로 늘립니다. 이는 부분적으로 아프리카의 수수께끼를 설명할 수 있습니다. 즉, 북부 및 동부 아프리카 인구에서 H. pylori 감염률 은 높지만 위암 발생률은 낮습니다[ 86 , 87 ]. H. pylori 균주에는 숙주 집락화의 유병률 증가, 세균 독성 및 그에 따른 위축성 위염 및 위암 등 의 역학적 차이가 있습니다 [ 86 , 87 ].
4.2. CagA 및 EPIYA 운송
병원성 CagA 양성 H. pylori 균주는 일본, 한국, 중국(90~95%), 콜롬비아(70%) 등 위암 위험이 높은 국가에서 더 널리 퍼져 있으며 북아프리카 및 기타 위암 위험이 낮은 지역(미국)에서는 더 낮습니다. , 서유럽, 호주(40%)). 위암 발생의 유도는 CagA 티로신 인산화 모티프(글루타메이트-프롤린 이소류신티로신-알라닌, (EPIYA))의 변화와 관련될 수 있습니다. 현재 4개의 CagA EPIYA 모티프(A, B, C, D)가 있습니다. EPIYA A 및 B는 전 세계적으로 널리 퍼져 있으며 EPIYA-C는 주로 서양 국가의 H. pylori 계통에서 발견됩니다. 대부분의 서부 H. pylori 분리균에는 하나의 EPIYA-C 모티프(EPIYA-ABC 유전자형)만 포함되어 있는 반면, 일부는 2~3개의 EPIYA-C 반복(EPIYA-ABCC 및 EPIYA-ABCCC)을 가지고 있습니다. 추가 EPIYA-C 모티프를 보유하는 H. pylori 균주는 위암과 더 밀접하게 연관되어 있습니다. 이는 부분적으로 erbB2 , HGF-R , FGFR4 및 TGF-β 성장 인자 유전자의 전사 증가와 β-카테닌 , mmp7 및 etv4 유전자의 발현 증가 및 숙주 세포에서 APC 유전자 발현 감소를 유도하는 CagA EPIYA-ABCCC 모티프와 관련이 있습니다. [ 88 ]. EPIYA-ABD는 악성 동아시아 H. pylori 균주(중국, 한국, 일본)에서 거의 독점적으로 발견되며, 이는 EPIYA A, B 또는 C 발현 균주보다 위 상피에서 더 높은 수준의 IL-8 방출을 유도합니다[ 86 , 87 ] . CagA 관련 IL-8 방출은 주화성을 통해 염증 세포를 유인하여 숙주 염증 반응을 증가시킵니다. [ 89 ] (그림 1, 경로 8).
4.3. CagA 및 IV형 세균 분비 시스템(T4SS)
종양단백질 CagA는 H. pylori cag-병원성 섬(cag-PAI) 에 대한 마커로 , 이는 cagA , cagB , cagC , cagL , cagM , cagI , cagY 를 포함하는 31개의 유전자를 포함하고 IV형 박테리아 분비 시스템(T4SS)을 암호화합니다. . T4SS는 LPS의 헵토스 1,7-비스포스페이트, 염색체 DNA, 펩티도글리칸 및 cagA 유전자 산물을 포함하여 박테리아 산물을 숙주 상피 세포 세포질로 직접 전이시키는 데 사용됩니다. 이는 H. pylori 의 세린 프로테아제 고온 요구사항 A(HtrA)의 배설 에 의해 달성되며 , 이는 접합 단백질인 occludin과 claudin 8의 단편화와 E-cadherin의 절단으로 상피 세포 간 밀착 접합(TJ)을 파괴합니다. 기반의 세포 간 부착 접합(AJ). H. pylori 의 세포주위 이동은 기저측 세포막에서 α5β1 및 α5β6 인테그린의 T4SS 바늘형 세균 필라 결합과 CagA를 위 상피 세포에 주입하는 것을 가능하게 합니다. T4SS는 또한 HopQ 부착물을 통해 숙주 세포막의 암배아 항원 관련 세포 부착 분자군(CEACAM)과 상호작용하여 CagA 제품을 전달할 수 있습니다. HtrA는 H. pylori 에 감염된 상피 세포 에서 E-cadherin 수준의 40% 감소와 관련이 있으며 , 이는 정상적인 위 점막 장벽의 심각한 붕괴를 나타냅니다[ 90 ] (그림 1, 경로 7).
주입된 H. pylori 펩티도글리칸은 세포질 뉴클레오티드 결합 및 올리고머화 도메인 1(NOD1)에 의해 병원체 관련 분자 패턴(PAMP)으로 인식됩니다. 그런 다음 NOD1은 수용체 상호작용 단백질인 세린-트레오닌 키나제 2(RICK)와 결합합니다. 이는 NF-κB의 활성화, NF-κB의 핵으로의 전위, IL-8 및 케모카인(CXC 모티프) 리간드 2(CXCL2) 방출을 통한 전 염증 반응의 유발을 초래합니다.그림 1, 경로 8). 세포 증식은 또한 인간 β-defensin-2(HBD-2) 및 CXCL2를 통해 핵 NF-κB에 의해 활성화됩니다. HBD-2는 H. pylori 를 비롯한 그람 음성균의 음전하를 띠는 인지질 세포막과 정전기적으로 상호작용하여 박테리아 세포막 투과성을 증가시키고 박테리아 사멸을 유도하는 양이온성 항균 펩타이드입니다. HBD-1 및 HBD-2의 항균 활성은 고염 조건에 의해 완전히 억제될 수 있으며, 이는 H. pylori 집락화에 영향을 미칠 수 있습니다[ 91 ] (그림 1, 경로 11).
4.4. CagA 및 Src
H. pylori CagA가 위 상피 세포 세포질에 주입되면 EPIYA 모티프는 티로신 키나제(Abelson 쥐 백혈병 바이러스 종양유전자 동족체 1(c-Abl) 또는 Src 계열 티로신 키나제(SFK))에 의해 인산화됩니다 . 인산화된 EPIYA-A 또는 B는 C 말단 Src 키나제(Csk)와 이원 복합체를 형성한 다음 SFK를 인산화하고 비활성화합니다. 따라서 EPIYA-C 또는 D 모티프 만이 Src-Homology 2(SH2) 도메인 이노시톨 포스파타제(SHIP2)를 활성화할 수 있으며, 이는 하류 Ras/MEK/ERK 신호 전달, NF-κB 핵 전위, 초점 접착 키나제( FAK) 세포 액틴 세포골격의 불활성화 및 재구성. 이로 인해 위 상피 세포가 균일한 다각형 모양에서 바늘 같은 돌기( 벌새 표현형 ), EMT, 중간엽 마커(SNAIL, vimentin 및 ZEB1) 및 줄기 세포(CD44) 마커의 발현, 억제되지 않는 증식이 있는 길쭉한 상태로 변형됩니다. 및 감소된 세포사멸 [ 86 , 87 , 92 ] (그림 1, 경로 8).
4.5. CagA, 비타민 C 및 후성유전 프로그래밍
CagA 양성은 E-cadherin( CDH-1 ), PTEN 및 CDKN2A 와 같이 세포 부착 및 세포 주기 제어를 담당하는 유전자의 과메틸화와 밀접한 관련이 있습니다 . CpG 디뉴클레오티드(CIMP)와 히스톤을 포함하는 DNA 시토신의 메틸화는 주요 억제 유전자의 후생적 침묵을 초래합니다. H. pylori 의 박멸은 CDH-1을 포함하여 산화 스트레스와 DNA 메틸화 수준을 감소시키는 것으로 나타났습니다 [ 94 ]. DNA 탈메틸화에는 5-메틸시토신(5-mCyt)이 5-히드록시메틸시토신(5-hmCyt)으로 전환되는데, 이는 α-케토글루타레이트 의존성 디옥시게나제(α-KGDDs)의 TET(ten-eleven translocation) 계열이 필요합니다. CagA 양성은 TET 메틸사이토신 디옥시게나제 1(TET1)의 손실 및 PTEN의 발현 감소와 밀접한 관련이 있습니다[ 95 ]. TET DNA 수산화효소는 촉매 활성을 위해 2-케토글루타레이트와 철(Fe 2+ )이 필요합니다. 아스코르브산은 콜라겐 생성에 필요한 프롤릴 수산화효소 및 리실 수산화효소 디옥시게나제 효소와 유사한 방식으로 α-KGDD 복합체에서 비활성 제2철(Fe 3+ ) 형태의 철을 제1철(Fe 2+ )로 감소시킵니다. 따라서 TET에 의한 5-mCyt의 수산화에는 중요한 보조 인자로서 아스코르브산이 필요합니다. 약리학적 및 생리학적 비타민 C 투여는 혈액학적 악성종양(AML)과 위암 및 대장암과 같은 고형암에서 DNA 탈메틸화를 향상시키는 것으로 나타났습니다 [ 96 , 97 , 98 ]. 아스코르베이트는 또한 Jumonji-C 도메인 함유 히스톤 탈메틸화효소(JHDM)뿐만 아니라 신진대사, DNA 복구 및 DNA/RNA 탈메틸화를 조절하는 기타 α-KGDD의 지속적인 기능에도 필요합니다. 히스톤 H3 꼬리의 메틸화된 리신에서 메틸 그룹을 제거함으로써 JHDM은 염색질 조절, 체세포 및 위암 발생에 대한 산화 스트레스의 후생적 영향을 재프로그램할 수 있습니다[ 98 , 99 ] (그림 5).
4.6. CagA, E-Cadherin 및 EMT
H. pylori CagA는 EMT 유도, 세포사멸 억제, 형질전환된 위 상피세포에 의한 줄기세포 특성 획득을 통해 발암성을 촉진하는 것으로 알려져 있습니다. 이는 TGF-β 및 NF-κB 방출에 대한 만성 염증의 영향과 종양 억제 경로(p53, CDH1/E-cadherin, APC, MGMT, MLH1, CDKN2A) 및 표준 티로신 키나제 신호 전달 경로의 조절 장애에 의해 달성됩니다. 여기에는 수용체 관련 티로신 키나제(EGFR/ErbB, HGFR/c-MET) 및 비수용체 키나제(Abl, JAK, FAK, c-src/Ras/MEK/ERK)가 포함됩니다[ 100 ]. 이러한 경로는 일반적으로 기관 형성, 조직 항상성, 세포사멸 및 상처 치유의 조절에 관여하지만 CagA 종양단백질에 의해 '납치'되어 위 종양을 유발할 수 있습니다[ 101 , 102 , 103 ].
E-cadherin은 부착 접합의 주요 막관통 당단백질이며 카테닌(α-, β-, γ- 및 p120), APC 단백질 및 세포골격 액틴에 결합됩니다. E-cadherin은 세포간 접착, 조직 구조, 세포 극성을 유지하고 EMT를 억제하여 종양 억제자 역할을 합니다. 인산화되지 않은 CagA는 E-cadherin과 직접 상호작용하여 E-cadherin/catenin/actin 세포골격/APC 복합체를 파괴하고 그에 따라 비정상적인 β-catenin과 p120 catenin이 세포질과 핵으로 전이됩니다. 이 과정은 CagA의 Src 관련 티로신 인산화와 무관합니다 .그림 1, 경로 7). APC는 부착 접합부와 연관되어 있으며 일반적으로 유리 β-카테닌을 분해하고 핵 전이를 방지함으로써 종양 억제자 역할을 합니다. 위 상피 세포에서 β-카테닌의 핵 전위는 β-카테닌 의존성 발암 경로(cyclin D1, c-MYC, CDX1)의 전사활성화를 유도합니다. 핵 β-카테닌에 의한 cdx1 유전자 의 자극은 CDX1, 장 분화 마커 MUC1, 줄기 세포 단백질 CD44, SOX2, Oct4 및 Nanog 및 EMT 마커(vimentin, SLUG)의 발현을 유도합니다. 이로 인해 위 점막이 장상화생, 장형 위암으로의 진행, 회전 타원체 형성 및 5-FU 및 시스플라틴에 대한 화학요법 저항성을 갖는 표현형과 같은 줄기 세포로 변환됩니다[ 104 , 105 ].
p120 카테닌의 핵 전위는 매트릭스 메탈로프로테이나제-7(MMP7) 또는 "마트릴리신"의 발현 증가를 촉진합니다. MMP7은 IV형 콜라겐, 카제인, 젤라틴, 프로테오글리칸 및 피브로넥틴의 단백질 분해 절단에 의해 세포외 기질과 기저막을 분해하는 아연 의존성 엔도펩티다제입니다. 이를 통해 상피 세포가 기저막에서 분리되어 이동할 수 있습니다. MMP7은 또한 혈관신생과 위암의 진행을 직접적으로 촉진합니다. 세포질 p120 카테닌은 세포질 액틴 세포골격의 재구성에 관여하는 Rho GTPase와 상호작용하여 위 상피 세포 운동성과 전이 능력을 촉진합니다. 부착 접합부에서 용해성 E-카드헤린이 방출되면 EGFR/ErbB 막 수용체와 Ras/MEK/Erk 경로도 활성화될 수 있습니다[ 106 , 107 , 108 ] (그림 1, 경로 7).
CagA는 위암 발병의 시작에 중요한 프로모터 유전자에 영향을 미칩니다. 여기에는 ZEB1 전사를 통한 EMT 촉진 및 Hippo/LATS2/YAP1/TEAD 경로를 통한 위 상피 줄기 세포 분화의 정상적인 항상성 조절 중단이 포함됩니다[ 109 ]. CagA 양성 H. pylori 에 감염된 인간 위 상피(AGS) 세포에서 양이온 수송 조절자 1(CHAC1) 과발현 은 글루타밀사이클로트랜스퍼라제 활성을 통해 글루타티온을 분해하여 ROS의 축적을 초래하는 것으로 나타났습니다[ 110 ]. CagA는 또한 Bcl2 결합 단백질(Bbp)/종양 억제 인자 p53 결합 단백질 2(p53 BP2)로도 알려진 종양 억제 인자 세포사멸 자극 단백질 p53 2(ASPP2)를 방해하며 CHAC1은 체세포 돌연변이 기능 상실을 유발합니다. TP53 종양 억제 유전자[ 101 , 102 , 103 , 110 , 111 ]. CagA는 E3 유비퀴틴 리가제, ARF-BP1(ARF 결합 단백질 1) 및 HDM2(인간 이중 분 2)에 의한 TP53의 분해를 증가시켜 세포사멸 실패, 아노이키스에 대한 저항성, EMT 및 위 줄기 세포 생성을 유발할 수 있습니다 . .
CagA의 일부는 AGS 미토콘드리아에 국한되어 있으며, 그곳에서 미토콘드리아 전자 수송 복합체 I 및 III에 의해 ROS 생산을 생성합니다. 이러한 ROS는 GSH 전구체 N-아세틸 시스테인(NAC), 카탈라아제, 알로푸리놀 또는 데스페리옥사민과 같은 항산화제에 의해 제거될 수 없습니다. ROS가 축적되면 PHD 활동이 감소합니다. HIF-1α의 안정화 및 전사 증가; SIRT3의 저하. 이는 정상 산소 상태에서도 VEGF , LDHA 및 PDK1 의 발현을 포함한 저산소증 반응 요소(HRE) 하류 표적의 활성화를 유도하여 위 종양의 시작 및 진행을 촉진합니다[ 112 ].
4.7. CagA와 염증
CagA는 TNF-α, NADH 산화효소(NOX 1), 병원체 유도성 산화질소 합성효소(iNOS), IL-1β와 같은 염증 매개체의 방출을 증가시킬 뿐만 아니라 T 세포의 위 점막으로의 활성화 및 이동을 유도합니다. IL-8 및 IL-10[ 114 ]. 위 점막 TNF-α 및 IL-1β의 방출 증가는 벽 세포 HCl 방출 및 위 무산소증의 억제와 관련이 있습니다. 이러한 강화된 염증, 면역원성 및 세포독성으로 인해 CagA 양성 H. pylori 균주는 만성 위축성 위염 및 장상화생의 위험이 상당히 증가하는 것과 관련이 있습니다(OR, 3.48; 95% CI, 1.02~12.18). 위암으로의 진행(OR, 1.64; 95% CI, 1.21~2.24) [ 6 ]. 호중구에 대한 헬리코박터 유도 화학주성은 CagA와 독립적인 것으로 보이며, Th1 면역 반응의 활성화를 유도하는 숙주 상피 세포막 TLR-2에 결합하는 Hp-NAP와 더 관련이 있는 것으로 보입니다[ 115 ]. 종양 관련 호중구(TAN)는 IL-17a의 방출과 IL-17a/JAK2/STAT3 신호 전달의 활성화를 통해 위 상피에서 EMT를 유도합니다[ 116 ] (그림 1, 경로 6).
4.8. 휴가
대부분의 H. pylori 에서 생성되는 VacA는 세포막 투과성을 증가시키고 세포막 티로신 키나제 수용체를 자극하며 글루타티온 수준을 감소시키는 기공 형성 독소입니다. 글루타티온은 자유 라디칼 제거 특성, 헤테로사이클릭 아민(HCA) 대사 산물과 같은 독소를 해독하고 DHA를 활성 형태인 아스코르베이트로 다시 환원시키는 등 여러 가지 중요한 작용을 합니다[ 117 , 118 ]. VacA에 대한 위 상피 세포 표면 수용체는 다음과 같이 다양합니다.
-
수용체 유사 단백질 티로신 포스파타제 α(RPTPα),
-
수용체 유사 단백질 티로신 포스파타제 β(RPTPβ),
-
표피 성장 인자 수용체(EGFR),
-
지질 뗏목/글리코실포스파티딜이노시톨 고정 단백질(GPI-AP),
-
스핑고미엘린(SM),
-
피브로넥틴(FN),
-
헤파린(H) 및 헤파란 황산염(HS),
-
저밀도 지질단백질 수용체 관련 단백질-1(LRP1),
-
그리고 하나의 T 림프구 수용체: CD18[ 119 ].
4.9. VacA 및 공포증
VacA는 위 점막 세포에서 세포질 액포의 형성을 유도하여 원형질막을 더 투과성으로 만들어 손상되기 쉽습니다. VacA는 음세포 의존성 및 클라트린 독립적 세포내이입에 의해 위 상피 세포로 내재화될 수 있으며 막횡단 전위를 감소시키고 시토크롬 C를 방출하여 미토콘드리아 기능 장애를 일으킬 수 있습니다. 이는 위 상피 세포에서 산화 스트레스와 미토콘드리아 매개 세포사멸을 유발합니다. VacA가 내부화되면 암모늄 이온의 축적과 삼투를 통한 물 유입으로 인해 위 세포 엔도솜으로의 위 상피 세포의 공포화가 발생합니다. 따라서 VacA의 병원성은 H. pylori 우레아제와 GGT 에 의한 암모니아 생산에 달려 있습니다 .그림 1, 경로 4).
4.10. VacA와 CagA
VacA는 T-림프구 증식을 차단하고 IL-2 생산을 감소시킴으로써 면역관용성 위 미세환경에 기여합니다[ 119 ]. VacA는 또한 p38/MAPK, ERK1/2 및 VEGF의 하류 활성화를 포함한 단백질 키나제를 활성화합니다. VacA는 cag-PAI의 일부는 아니지만 CagA와 상승적으로 작용하여 AP-1의 활성화뿐만 아니라 위 점막 세포에서 지속적인 집락화 및 철분 추출을 가능하게 할 수 있습니다. AP-1은 IL-8, IL-6, TNF-α 및 NF-κB와 같은 사이토카인의 발현 및 동원을 조절합니다. vacA 발현 의 변화는 또한 H. pylori 독성에 영향을 미칩니다. s1 또는 m1 유전자형은 AG 및 IM과 더 유의하게 연관되어 있습니다 [ 6 , 119 , 120 ]. 대부분의 CagA 양성 H. pylori 균주는 독성 s1 VacA 형태와 OipA 접착체를 갖고 있는 반면, CagA 음성 균주는 OipA가 없는 비독성 s2 vacA 형태를 가지고 있습니다. VacA와 CagA가 상호 길항작용을 가질 수 있다는 증거도 있습니다. CagA는 VacA 유도 공포증 및 세포사멸을 억제하고, VacA는 위 상피 세포에서 CagA 유도 벌새 증식 표현형을 억제합니다[ 119 , 121 ].
5. 헬리코박터 부착균, 혈액형 및 비타민 C
헬리코박터 파일로리 외막 단백질(OMP)은 5개의 유전자 계열 구성원으로 구성됩니다. 첫 번째이자 가장 큰 계열 구성원에는 서로 다른 친화력으로 숙주 세포막 수용체에 부착되는 H. pylori 외막 포린(HOP) 접착 분자가 포함됩니다. 부착 관련 지질단백질 A(AlpA), 외부 염증성 단백질 A(OipA), HopQ, HopZ, 혈액형 항원 결합 부착물(BabA) 및 시알산 결합 부착물(SabA)을 포함하여 21가지 HOP 부착물이 있습니다[ 86 ]. BabA는 BabA2 유전자 에 의해 암호화되며 , BabA2에는 다양한 변형이 있습니다. BabA는 적혈구뿐만 아니라 위 상피에서도 발현되는 H, Lewis b(Leb) 및 푸코실화된 ABO 혈액형 항원에 결합합니다. 위 상피에 발현된 Sialyl-Lewis x 및 sialyl-Lewis 항원은 SabA에 의해 인식됩니다[ 122 ]. BabA를 통해 H. pylori 가 위 점막에 부착되면 H. pylori가 T4SS를 통해 위 상피 세포로 VacA 및 CagA를 보다 효과적으로 전달하는 데 도움이 됩니다. 정점 막 부착은 또한 H. pylori 가 위 내강으로 흘러 들어가는 것을 방지하고 손상된 숙주 상피에서 박테리아에 안정적인 영양분 공급을 제공합니다. H 항원이 있는 혈액형 O 환자와 Leb 항원이 있는 피험자는 소화성 궤양 질환의 발생률이 더 높으며, 이는 H. pylori 가 위 상피의 H 및 Leb 항원에 대한 부착이 강화되었음을 시사합니다. Suet al. OipA, BabA 및 SabA 항체의 조합이 위암 진단에서 77.3%의 양성 예측률을 제공한다는 사실을 발견했는데, 이는 H. pylori 균주의 발암성이 부착 단백질의 발현과 밀접한 관련이 있음을 시사합니다[ 123 ] (그림 1, 경로 3).
적혈구 표면, 내피, 신장, 비뇨생식기 및 위장관 표면에 발현되는 루이스 항원으로는 Le(a+, b-), Le(a-, b+), Le(a-, b-)가 있습니다. Leb에 대한 BabA의 결합 친화도가 더 우수할 뿐만 아니라 루이스 항원은 ABH 항원의 분비와 밀접하게 연결되어 있습니다. Le(a-, b+) 및 Le(a-, b-) 유전자형은 ABH 분비와 관련이 있는 반면, Le(a+, b-)는 비분비자입니다(즉, Lewis α 환자는 점액선을 통해 ABH 항원을 분비하지 않습니다) 위장관). 이는 H 항원이 있지만 Lewis a도 있는 혈액형 O 환자는 위 점막에 H 항원이 없으며 H. pylori BabA가 효과적으로 부착될 수 없음을 의미합니다. 혈액형 O형 환자는 H. pylori 부착소 와의 결합이 좋아 과다출혈과 십이지장 궤양 질환이 있는 반면 , 혈액형 A형은 위암 발생 위험이 더 크다[ 124 , 125 , 126 ].
혈액형 O형 환자는 H. pylori 에 대한 전염증성 사이토카인 IL-6 및 TNF-알파 반응이 더 크지 만 항염증성 사이토카인 IL-10은 그렇지 않습니다[ 127 ]. Nakao et al.은 위암 환자 703명과 비암 환자 1,465명을 대상으로 한 연구입니다. [ 128 ] 혈액형 A 환자의 위암 위험이 통계적으로 유의하게 증가했으며 혈액형 B 및 O 환자와 관련된 위험 감소가 입증되었습니다. A형 혈액형 환자는 악성빈혈, 만성위축성위염에 걸리기 쉬우며 위암 발생률도 높다. 또한 혈액형 A 환자의 종양에 대한 면역 반응은 혈액형 O 환자보다 낮습니다. 이는 혈액형 A 탄수화물 항원과 위암 A형 Thompsen-Friedenreich(TF) 항원 간의 유사성과 관련이 있으며, 결과적으로 숙주 TF 응집소 반응이 낮아집니다[ 127 , 129 ]. Jaffet al. 한국인 환자의 경우 혈액형 B가 H. pylori 감염에 가장 취약한 것으로 나타났으며, 혈액형 O 환자는 H. pylori 유발 궤양에 가장 취약한 것으로 나타났습니다[ 130 ]. H. pylori 와 만성 위축성 위염 의 연관성이 밝혀지기 전에도 혈액형 O형 환자의 위에서 유리 HCl 생산량이 86%로 높았고, 혈청 펩시노겐 수치(564U/mL)도 더 높은 것으로 알려져 있었습니다. 각각 혈액형 A 환자(73%) 및 494 U/mL [ 131 ]. 왕 외. (2012)은 A형 혈액형을 가진 개인이 B형 혈액형보다 H. pylori 에 감염될 가능성이 더 높다는 것을 보여주었습니다 [ 117 ]. 광범위한 영상 기술을 통해 이 연구는 A형 항원이 있는 적혈구에 대한 H. pylori 부착이 강화되었음을 보여주었습니다.
혈액형 A를 갖는 환자는 정상적인 내강 비타민 C 수준 및 위 pH를 갖는 경향이 있는 위축이 없는 혈액형 O를 갖는 환자에 비해 비타민 C 수준의 위 분비를 손상시키는 위축성 위염의 위험이 증가합니다. 미만성 전정부 위염 및 십이지장 궤양은 위액 비타민 C 및 무위산증이 낮은 범위염, 신체 위축성 위염 또는 장화생 환자와 비교하여 정상적인 위내 비타민 C 수치와 관련이 있습니다. 이는 H. pylori 관련 십이지장 궤양 환자에서 위암이 거의 발생하지 않는 현상을 설명할 수 있다 [ 70 , 114 ]. 중증 위축 환자(0.56 mL/min, 0.27~1.20)의 위 아스코르빈산 분비는 위축이 없는 환자(1.51 mL/min, 0.59~3.30)나 경증 위축 환자(1.43 mL/min, 0.53)에 비해 현저히 낮았습니다. –3.78) 및 중등도(1.31mL/분, 0.47–3.16) 위축( p < 0.005). 아스코르브산 분비와 위축의 정도 사이에는 유의한 음의 상관관계가 있었습니다(상관 계수 = -0.43, p < 0.005) [ 42 ].
적혈구 혈액형 또는 위점막 탄수화물 항원에 대한 긴밀한 부착은 H. pylori 가 활용하기 위해 숙주로부터 철분을 추출하는 것을 허용합니다 [ 117 ]. 이는 만성 H. pylori 위염 에서 난치성 철결핍성 빈혈 현상을 설명할 수 있으며 , 이는 혈액형 A 환자에서 가장 두드러지고 혈액형 O 환자에서는 가장 적습니다. 철은 또한 H. pylori 에 의해 펜톤 반응을 일으킬 수 있습니다 . 철은 과산화수소와 과산화물을 촉매하여 수산기 라디칼을 형성하고 지질 과산화 및 DNA 손상을 유발합니다.
펜톤 반응: 2Fe 2+ + 2H 2 O 2 → 2Fe 3+ + 2OH · (하이드록실 라디칼) + 2OH − [ 112 ].
Akatsukaet al. Fenton 화학 반응이 하이드록실 라디칼을 생성하여 상당한 게놈 변화(특히 결실)를 유발하고 발암에 기여한다는 것을 쥐에서 보여주었습니다. [ 132 ] (그림 6).
6. 비타민 C와 H. pylori
6.1. 만성 위축성 위염, H. pylori 및 비타민 C
H. pylori는 비위축성 위염이나 만성 위축성 위염을 유발할 수 있습니다. 코퍼스 우세형 만성 위축성 위염은 벽세포의 손실, 고가스트린혈증, 항두정세포 항체(항-H + /K + ATPase Ab, 항내인성 인자 Ab) 생성, 위줄기 및 전구세포에 의한 증식 증가, 및 정상 위 상피를 완전 또는 불완전 IM으로 대체합니다. 이는 또한 말뭉치 또는 안저의 "유문전이화" 또는 "가성유문화생"이라고도 합니다. 고가스트리나혈증은 COX-2와 Bcl-2 및 서바이빈과 같은 항세포사멸 단백질의 발현을 증가시킵니다. 이는 위점막 위축 및 불완전화생 부위에서 발암 및 혈관신생을 촉진할 수 있습니다[ 133 ] (그림 1). 화생성 세포 중 일부는 진경성 폴리펩티드 발현 화생(SPEM)에 관여하는 세포 주기로 다시 모집된 효소 생성 주세포에서 발생하는 것으로 제안됩니다. 진경성 펩타이드는 정상 장 점막에서 특징적으로 발현되는 개미자리 펩타이드이다[ 57 , 134 , 135 ]. AG 및 IM의 주요 세포 손실은 낮은 혈청 펩시노겐 I 수준과 펩시노겐 I/II 비율에 의해 반영됩니다[ 114 ]. 질병 과정 후반에 일부 화생 세포는 위 점막으로 이동한 골수 유래 줄기 세포에서 유래합니다[ 118 ] (그림 5).
Cag-A 양성 H. pylori 균주는 만성 위축성 위염 및 IM과 밀접한 관련이 있으며 위암을 유발할 가능성이 더 높습니다 [ 6 ]. 이는 부분적으로 만성 무산소증, 비타민 C의 활성 분비 감소, 만성 위축성 위염의 자유 라디칼 손상, 프로모터 유전자의 지속적인 과메틸화 때문일 수 있습니다[ 114 ]. 비타민 C는 두 가지 해리 pKa(4.17과 11.6)를 갖는 이산(bi-acid)입니다. 이는 정상 위의 산성 환경(pH < 4)에서 더 많은 비율의 비타민 C가 산화된 형태의 DHA보다 더 강력한 항산화제인 음이온인 아스코르베이트로 해리된다는 것을 의미합니다[ 6 , 136 ]. 위 무산소증(pH > 4)의 알칼리성 환경에서는 아스코르베이트에 대한 해리가 적어 항산화 보호 효과가 떨어집니다.그림 4).
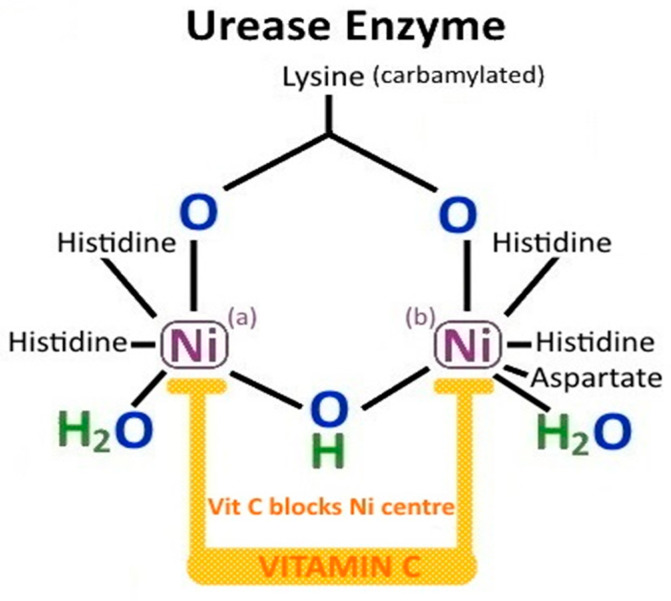
비타민 C는 상대적으로 강한 산이며 인간 위의 전반적인 산성도(공복 pH = 2)에 기여합니다. 이는 병원성 장내 유기체로부터 숙주 위 세포 보호에 중요합니다. 비타민 C는 또한 위 내강으로의 점액 분비를 자극하는 프로스타글란딘 E2(PGE2)의 합성을 90~100% 증가시켜 H. pylori 의 집락화나 신체적 손상으로부터 위 상피를 보호하는 데 도움이 됩니다 . DHA-금속 이온 복합체에 의한 설필히드릴이 풍부한 우레아제 효소의 티올 산화와 별도로, 아스코르브산은 H. pylori 우레아제 효소 의 중심에서 발견되는 Ni 2+ 와도 반응합니다 . 아스코르브산은 DHA-Ni 2+ 복합체 로 산화되어 이량체 니켈 중심을 감소시키고 우레아제 효소를 비가역적으로 비활성화시킵니다(그림 7). 이로 인해 우레아제 분자가 불안정해지고 H. pylori 유기체가 생존할 수 있는 알칼리성 환경을 만들 수 없게 됩니다. H. pylori 는 호산성균이 아니며 우레아제 효소가 비활성화된 경우 위 pH 4.0~8.0에서만 생존할 수 있습니다. 비타민 C는 또한 표준 4중 요법(78% 대 48.8%, p <0.0001) 과 비교하여 4중 요법(비스무트, 메트로니다졸, 아목시실린, 오메프라졸)과 결합하여 H. pylori 제균율을 향상시키는 것으로 나타났습니다 . 따라서 비타민 C는 H. pylori 유기체 의 초기 집락화로부터 위를 보호할 수 있지만 확립된 H. pylori 위염 에 대한 근절 요법에도 유용할 수 있습니다 [ 137 ].
6.2. H. pylori와 위 아스코르빈산 분비
H. pylori 와 관련된 만성 위축성 위염은 위액 아스코르브산 분비를 실질적으로 낮춥니다 [ 138 ]. Waringet al. 혈장 및 위점막 아스코르브산 농도는 만성 위염의 존재에 영향을 받지 않는 반면, 위 내강 아스코르브 산 농도는 상당히 낮았다[ 139 ]. 특히 비타민 C가 보충되지 않은 저산소증(위 pH > 4) 환자의 경우 더욱 그렇습니다. 이 환자들은 저산소증이 없는(위 pH < 4) 보충되지 않은 환자들에 비해 아스코르빈산 위액 농도 중앙값(9 µmol/L, 범위 0~82 µmol/L, p < 0.05)이 매우 낮았습니다. 중앙값(39μmol/L, 범위 0~483μmol/L). 경구 비타민 C 보충은 정상 위점막 환자보다 만성 위염 환자에서 내강 위 아스코르베이트 수치 개선에 덜 효과적이었습니다[ 139 ]. H. pylori 감염 환자의 위액 아스코르브산 농도는 감염되지 않은 환자에 비해 상당히 낮습니다(19.3 µmol/L(사분위간 범위(IQR) 10.7–44.5) 대 66.9 µmol/L(IQR 24.4–94.2), p = 0.003). H. pylori CagA 양성 환자는 CagA 음성 H. pylori 감염 환자 보다 위액 아스코르브산 농도가 낮습니다 (14.8 µmol/L(IQR 7.9–52.2) 대 39 µmol/L(IQR 19.9–142.2), p = 0.05) [ 114 ].
6.3. H. pylori 제균 및 비타민 C
H. pylori는 헬리코박터 포스포리파제, 프로테아제 및 시토크롬 C 산화효소 의 소비로 인해 위 내강 아스코르브산 감소에 기여합니다 . 염증 세포 이동에 의한 ROS 방출 증가; 손상된 위 상피로 인해 위 pH가 증가하고 아스코르빈산의 활성 분비가 손상됩니다. H. pylori 의 박멸은 위액의 아스코르브산 수치를 개선하는 것으로 나타났습니다[ 140 , 141 ]. Sobalaet al. [ 142 ] 성공적으로 H. pylori 제균을 달성한 환자와 제균에 실패한 환자에서 위내 아스코르빈산 수치가 크게 회복된 것으로 나타났습니다. 위액 아스코르브산 수치의 증가는 최종 혈장 비타민 C 수치가 >30 μmol/L인 H. pylori 제균 환자에서 혈장 수치가 < 30 μmol/L인 결핍 환자에 비해 더 높았습니다. 또한 지속적인 H. pylori 감염이 있는 경우 경구 비타민 C 보충만으로는 위액 아스코르베이트 수준을 증가시킬 수 없는 것으로 나타났습니다 [ 142 ]. Annibaleet al. (2003)은 만성 표재성 H. pylori 위염 환자에서 H. pylori 제균으로 위내 pH가 감소하고(4~2) 위액 아스코르브산 수치가 증가(9.02~14.48 mcg/mL)했다고 보고했습니다. H. pylori 제균을 달성한 기존 H. pylori 관련 위위축 환자의 변화 [ 143 ]. 위축성 위염에서 H. pylori 감염은 또한 위 무산소증을 유발하여 아질산염 형성 박테리아의 과증식을 촉진하고 아질산염 및 N-니트로소 화합물의 형성과 아스코르브산염의 산화를 증가시킵니다[ 144 ].
6.4. 식물화학물질, CagA 및 위암 예방
CagA가 만성 위축성 위염을 유발하고 위강으로의 비타민 C 분비 감소의 효과는 부분적으로 위 형성이상 및 선암종 예방 연구에서 과일과 채소의 식이 식물화학물질의 다양한 효능을 설명할 수 있습니다. 긍정적인 결과[ 85 , 145 , 146 , 147 ], 부정적이고 모호한 결과[ 148 , 149 , 150 , 151 , 152 , 153 ] 가 있었으며 , 그 중 일부는 연구 능력 및 설계, H. pylori 독성, 내시경 평가, 기준선 조직학, 이질성, 기타 위험 요인 제어, 혈장 비타민 C 상태 평가, 식이 회상 및 추적 기간 [ 146 , 147 , 148 , 149 ]. 예를 들어, 동아시아 국가(한국, 일본, 중국)에서 전향적으로 수집된 810명의 비심장성 위암 사례와 1,160명의 대조 대조군에 대해 H. pylori CagA 상태, 인구통계, 생활 방식, 흡연 및 식이 데이터 와 관련된 통합 분석이 수행되었습니다. . 과일 섭취량이 많을수록 비심장성 위암 위험 감소와 관련이 있었습니다(OR = 0.71, 95% CI: 0.52–0.95, p -trend = 0.02). H. pylori 항체 의 증거가 없는 과일을 많이 섭취하는 소비자는 CagA 양성 H. pylori 에 감염된 과일을 적게 섭취하는 소비자와 비교할 때 위암 발병 확률이 가장 낮았습니다(OR = 0.12, 95% CI: 0.06–0.25) . 그러나 CagA 양성 H. pylori 에 감염된 개인에서는 높은 과일 섭취와 역의 연관성이 사라졌습니다 (OR = 0.82, 95% CI: 0.66–1.03). CagA 음성 피험자의 전반적으로 낮은 비율과 과일 섭취량이 많은 비흡연 상태는 연구에서 잠재적인 혼란 요인이었습니다[ 154 ].
7. 프로바이오틱스와 헬리코박터 박멸
H. pylori 박테리아 의 항생제 내성 출현으로 헬리코박터 박멸율을 높이기 위한 프로바이오틱스 사용에 대한 관심이 자극되었습니다. L. acidophilus 및 L. bulgaricus 와 같은 살아있는 유기체는 위 점액 보호 장벽을 강화하고, 위 상피 세포에 대한 H. pylori 부착을 억제하고, 숙주 면역을 자극하고, H. pylori 와 영양분 경쟁을 하며 살균제를 생산하는 것으로 나타났습니다 (SCFA 및 박테리오신). 프로바이오틱스는 삼중 요법과 함께 사용하면 H. pylori 제균율을 높이고 , 위장관 내 미생물 다양성 손실과 그에 따른 항생제 치료의 부작용을 예방할 수 있습니다. 락토바실러스 종. 과산화물과 수산기 라디칼을 제거하는 항산화제 생산을 통해 위에서 산화 스트레스와 위 신생물의 시작을 감소시킬 수 있으며, NF-κB, STAT3 및 사이토카인 방출의 H. pylori 매개 활성화를 억제하여 위 염증을 감소시킬 수도 있습니다. (TNF-α, IL-8, iNOS, COX-2). 빠른 세포 증식을 위해서는 폴리아민이 필요하기 때문에 프로바이오틱 치료가 폴리아민 합성을 감소시켜 위암 발생을 억제할 수 있다는 일부 증거가 있습니다 [ 155 , 156 , 157 , 158 , 159 , 160 ].
8. 위암의 식생활 및 환경적 위험인자
역학 연구에 따르면 아질산염과 니트로사민 함량이 높은 절임, 발효, 가공 또는 훈제 식품의 식단[ 161 ], 헤테로고리 아민 방출을 초래하는 굽기, 굽기 및 튀김과 같은 고열을 포함하는 조리 방법[ 118 , 162 ] 또는 다이어트 소금, 헴 철분, 붉은 고기 [ 163 ] 또는 포화 지방이 많이 함유되어 있으면 위암 [ 164 ]에 기여할 수 있습니다. 담배 흡연과 음주 역시 위암의 위험 요소이며, 식이 위험 요소 및 H. pylori 감염과 상승적으로 상호 작용할 수 있습니다. 아스코르브산, 카로티노이드, 폴리페놀, 플라보노이드 및 기타 식물화학물질이 시너지 효과를 발휘하여 위암을 예방할 가능성이 높기 때문에 합성 비타민 C 보충제보다 과일 및 야채 섭취를 늘리는 것이 좋습니다[ 36 , 147 ] (그림 8).
8.1. 식이성 니트로사민
니트로사민은 아질산염과 2차 아민이 반응하여 생성됩니다. 니트로사민 및 기타 N-니트로소 화합물(NOC)은 위암 발생에 관여하며 외인성 소스(예: 식품의 조리, 보존, 발효 또는 훈제 중, 담배 흡연)에서 파생되거나 위에서 내인성으로 생성될 수 있습니다. 니트로사민(ENOC)의 내인성 합성이 전체 노출의 대부분(45~75%)을 차지합니다. 니트로소디메틸아민(NDMA)과 같은 미리 형성된 니트로사민이 많이 함유된 식단을 섭취하면 위암 위험이 증가하는 것으로 나타났습니다(스웨덴 여성의 경우) [ 165 ]. 그러나 EPIC-EURGAST 연구에서는 외인성 NDMA가 위험 인자(HR, 1.00; 95% CI, 0.7~1.43)로 나타나지 않았습니다. NOC는 300개가 넘으며, 니트로사민의 90%는 발암성 입니다 . Stillwell과 Correa(1991)는 콜롬비아 인구 160명을 대상으로 질산염과 N-니트로소프롤린의 소변 배설을 측정하고 이들 중 118명에게 위 생검을 실시했습니다. 이 연구는 요로 질산염, N-니트로소프롤린, 장상피화생 및 이형성증 사이에 매우 중요한 연관성을 보여 주었으며, 이는 위암 발생에서 니트로사민 및 기타 N-NOC의 역할에 대한 증거를 뒷받침합니다[ 167 ].
니트로소 화합물은 C-니트로소 화합물(예: 니트로소알칸; RN=O), S-니트로소 화합물(니트로소티올; RS-N=O), N-니트로소 화합물(예: 니트로사민; R2N-N=O)로 분류될 수 있습니다. 및 O-니트로소 화합물(아질산 알킬; RO-N=O). N-니트로소 화합물은 니트로사민과 니트로소아미드(니트로소카바메이트 및 니트로소우레아 포함)로 분류될 수 있습니다.
니트로사민과 같은 식이성 미리 형성된 N-니트로소 화합물 외에도 염지육, 맥주, 베이컨, 햄 및 일부 소시지의 방부제로 사용되는 식이성 아질산염(NO 2 − )도 위암 발생과 관련이 있습니다[ 168 ]. 아질산염은 위에서 니트로실화 또는 니트로소화를 생성할 수 있습니다. 니트로실화는 비N-니트로소 화합물의 형성을 초래합니다( 철이나 티올과 같은 금속에 니트로실 이온 NO - 첨가). 니트로소화는 니트로소늄 이온 NO +를 아민 -NH2에 첨가하여 NDMA 또는 니트로소프롤린과 같은 니트로사민을 형성합니다. 이는 산성 pH 환경, 특히 위장(pH < 4)에서 발생합니다. 또는 위내 아스코르브산 수치가 낮은 경우. H. pylori는 NOS와 산화질소 수준을 증가시켜 내인성 니트로사민의 형성을 촉진합니다. H. pylori는 l-아르기닌/산화질소(NO) 경로를 통해 대식세포 시스템을 자극합니다. 따라서 만성 H. pylori 위염은 내인성 NO 형성을 증가시킬 수 있습니다. ROS에 의한 NO의 후속 산화는 니트로소화제 N 2 O 3 (삼산화이질소) 및 N 2 O 4 의 형성을 초래하며 , 이는 니트로사민을 생성하거나 다른 유형의 DNA 손상 또는 지질 과산화를 일으킬 수 있습니다 [ 169 ]. 산화질소는 위에서 붉은 고기나 가공육의 미오글로빈 및 헤모글로빈과 직접 반응하여 ENOC를 형성할 수 있습니다. 이는 비육류 단백질이나 무기 철분에서는 발생하지 않습니다. EPIC-EURGAST 연구에서는 ENOC와 비심장성 위암 사이의 연관성이 H. pylori 혈청 양성 환자(HR, 1.82; 95% CI, 1.32~2.51) 에서만 유의미했고 H. pylori 혈청 양성 환자 에서는 그렇지 않은 것으로 나타났습니다. 음성 환자 [ 170 ].
식이성 질산염(NO 3 − )과 아질산염은 N-NOC와 니트로사민을 형성할 수 있습니다. 아질산염은 보존제, 색상 고정제, 부패 박테리아 및 식품 매개 병원체( Clostridium botulinum) 억제제로 염지육에 첨가됩니다 . 질산염은 식품, 특히 잎이 많은 녹색 채소(시금치, 양상추, 비트 뿌리, 루콜라, 케일, 셀러리)에 널리 퍼져 있습니다. 질산염 자체는 발암성이 없지만 구강 내에서 박테리아에 의해 부분적으로 아질산염으로 환원될 수 있습니다 [ 171 , 172 ]. 아질산염은 산소헤모글로빈에 의해 질산염으로 산화되기 때문에 혈류를 순환하지 않습니다. 질산염은 섭취 직후 아질산염으로 전환될 수 있습니다. 질산염은 또한 소장에서 흡수되어 혈류를 순환하고, 타액선에 농축되고(혈장보다 10배), 타액으로 분비되고, 나중에 혐기성 구강 박테리아에 의해 아질산염으로 환원될 수 있습니다. 이는 질산염의 장타액 순환으로 알려진 보다 일반적인 경로입니다[ 171 ]. 섭취된 질산염의 약 25%는 장타액 순환을 거치는데, 이는 인간에게는 발생하지만 생쥐나 쥐에서는 발생하지 않습니다. 타액 질산염의 약 20%가 아질산염으로 전환되며, 이를 삼키면 다량의 식후 아질산염이 위 점막에 전달됩니다. 아질산염은 위산(HCl)과 반응하여 아질산(HNO 2 )을 생성할 수 있으며, 이는 아미드를 적극적으로 니트로소화하여 니트로사미드(HN 2 O 2 ) 를 형성합니다 . HNO 2 두 분자는 위에서 N 2 O 3 를 형성한 다음 니트로세이트 아민을 형성하여 위 니트로사민(H 2 N 2 O)을 형성할 수 있습니다. Ascorbate는 HNO 2 를 NO로 환원시키며, 또한 아민보다 N 2 O 3 와 더 빠르게 반응하여 니트로소화를 억제합니다. 위의 아스코르베이트/아질산염 비율이 감소함에 따라 위에서 화학적 니트로산화 속도가 증가합니다[ 161 ].
위 상주 혐기성 미생물군의 변화는 또한 H. pylori , AG 또는 장기 양성자 펌프 억제제 사용 으로 유발된 위 무산소증과 관련하여 니트로소화에 기여합니다 [ 161 ]. 위에서 공생하는 박테리아 발효는 높은 수준의 아질산염을 생성할 수 있으며, 특히 위 내강 아스코르브산의 위 분비 또는 해리가 너무 낮아 보호를 제공할 수 없는 경우 AG에서 높은 수준의 아질산염을 생성할 수 있습니다 . 따라서 위 무산소증 동안 pH가 5보다 높으면 박테리아 유래 질산염 환원효소가 아질산염 형성에 있어 위 HCl보다 더 중요합니다. 이는 내인성으로 형성된 NOC로 이어지며 위암 발생에 기여할 수 있습니다 [ 136 ]. AG, IM 및 상피 이형성증과 관련되고 16S rRNA 유전자 서열 분석으로 진단된 위 미생물 불균형은 성공적인 H. pylori 박멸 치료 후에 역전될 수 있습니다 . 이는 H. pylori 와 변경된 위 미생물군 이 위암 발생에 시너지 효과를 발휘한다는 것을 의미합니다 .그림 5).
8.2. 비타민 C, 파속 야채 및 니트로사민
알리움 야채(양파, 마늘, 샬롯)에는 알릴황 화합물이 포함되어 있습니다. 이는 니트로소티올의 형성을 선호하고 아질산염의 가용성을 감소시킴으로써 니트로사민(예: 니트로소프롤린)의 자발적이고 박테리아 매개된 형성을 억제합니다. 또한 니트로사민에 의한 DNA의 알킬화를 차단하여 N-NOC 위암 발생 위험을 줄입니다. 알리움 야채 섭취에 대한 2007년 세계 암 연구 기금 메타 분석에서는 복용량과 관련하여 위암 위험이 크게 감소하는 것으로 나타났습니다. 그러나 이는 EPIC 연구에서는 확인되지 않았습니다. 마찬가지로, 비타민 C는 정상 위 pH 2.5에서 위 니트로사민 형성 시 아질산염에 의한 아민의 내인성 니트로소화를 87~100% 억제하고 붉은 고기 유래 헴을 발암성이 없는 화합물인 니트로실-헴으로 니트로실화를 촉진합니다. [ 174 , 175 ]. EPIC-EURGAST 연구에서는 ENOC로 인한 비심장성 위암 위험이 혈장 비타민 C 수치와 상관관계가 있음을 보여주었습니다. 혈장 비타민 C 수치가 낮은(<40μmol/L) 환자의 경우 ENOC와 비심장성 위암의 관련 교차비는 심장암은 3.24(95% CI, 1.77~5.93)였지만, 혈장 비타민 C > 40 μmol/L(OR, 1.10; 95% CI, 0.63~1.93)인 환자에서는 연관성이 없었습니다. 이는 H. pylori 감염 환자 의 비타민 C 수치가 낮은 것과 관련이 있는 것으로 생각되었습니다 . 실제로 ENOCs와 낮은 혈장 비타민 C 위험 분석을 H. pylori 양성 환자로 제한했을 때 비심장성 위암 위험은 훨씬 더 높았다(OR, 3.52; 95% CI, 1.8-8.9) [ 170 ] (그림 5).
8.3. 헤테로사이클릭 아민
헤테로사이클릭 아민은 단백질이 풍부한 식품, 특히 고온에서 조리된 고기와 생선을 조리하는 동안 형성되는 돌연변이 유발물질입니다. 이 과정에는 단백질 열분해 또는 메일라드 반응이 포함됩니다[ 118 ]. Ohgakiet al. 은 조리된 음식에 포함된 헤테로사이클릭 아민이 생쥐, 쥐, 원숭이에게 발암성을 나타내는 것으로 나타났습니다[ 162 ]. HCA는 위암, 간암, 폐암, 혈관암, 결장암, 유선암, 림프종, 백혈병과도 관련이 있습니다.
항산화제, 폴리페놀 및 기타 식물화학물질이 풍부한 과일과 채소를 섭취하면 HCA와 니트로사민의 형성, 생체 활성화 및 발암성을 감소시킬 수 있습니다. 예를 들어, 요리하기 전에 붉은 고기에 마늘이나 양파를 추가하면 HCA인 2-아미노-3,8-디메틸이미다조(4,5-f) 퀴녹살린(MeIQx)의 형성이 66.2~88% 감소하고 2-아미노-1 -메틸-6-페닐이미다조(4,5-b)피리딘(PhIP) 79~94.3%. 섭취 후 HCA는 시토크롬 P4501A2, 설포트랜스퍼라제 및 N-아세틸트랜스퍼라제(NAT)를 통한 N-산화에 의해 활성화되어 부모 HCA보다 전반적인 유전독성이 더 큰 반응성 친전자성 종으로 전환됩니다. 인간의 NAT mRNA 발현 활성은 알리움 야채(예: 양파, 마늘)에 의해 억제될 수 있습니다[ 174 ].
Poplawskiet al. [ 118 ] HCA에 의해 유발된 DNA 손상은 H. pylori 에 감염되지 않은 피험자보다 H. pylori에 감염된 피험자에서 유의하게 더 높았으며 , 이는 H. pylori가 HCA의 돌연변이 유발 효과를 촉진한다는 것을 시사합니다. 그러나 비타민 C는 H. pylori 상태 와 관계없이 위 점막 세포에 대한 HCA의 독성 영향을 감소시킬 수 있습니다 . HCA는 또한 아스코르브산과 마찬가지로 강력한 항산화제인 글루타티온에 의해 결합되고 해독될 수 있습니다. H. pylori 에 의해 생성된 VacA는 세포 내 GSH 수준을 고갈시킬 수 있으므로 HCA의 돌연변이 유발 효과에 대한 위 점막의 노출을 증가시킵니다[ 58 , 118 ].
8.4. 소금과 H. pylori
소금은 1959년부터 염장고기, 간장, 젓갈, 절인 야채 및 기타 소금에 절인 식품의 다량 섭취와 관련하여 위암의 위험 요인으로 확인되었습니다.그림 8). D'Elia et al.의 메타 분석. 268,718명의 피험자 중 소금 섭취가 증가하면 위암 위험이 증가하는 것으로 나타났습니다 [ 176 ]. "높은" 및 "보통 높은" 대 "낮은" 소금 섭취는 각각 위암 위험 증가와 관련이 있었습니다(RR = 1.68 [95% CI 1.17–2.41], p = 0.005 및 RR = 1.41 [1.03–1.93], p = 0.032). 특히 일본 피험자들과 소금에 절인 생선, 발효 된장, 한국 김치 (절인 양배추)와 같이 소금이 풍부한 선택된 식품을 더 많이 섭취하는 사람들에게서 더욱 그렇습니다.
소금은 위 점막을 손상시켜 염증을 일으키고 H. pylori 의 집락화를 촉진합니다 . 다른 리뷰에서는 고염 상태가 고가스트리나혈증, 내인성 돌연변이, 위 상피 세포 증식, 위 점액 점도 변경, H. pylori CagA 및 니트로사민(예: N- 메틸-N- ) 의 효과를 강화함으로써 위암 발생에 관여한다고 제안했습니다. 니트로 -N- 니트로소구아니딘(MNNG)) [ 26 , 177 ]. 실제로 유사한 환자 유전적 구성 및 헬리코박터 계통 에도 불구하고 일본 현(예: 아키타(고염) 대 오키나와(저염))의 위암 사망률이 3배 더 높은 것은 식이 소금 섭취량의 큰 차이에 기인합니다. [ 178 ]. 식이 염분과 위암 사이의 유의미한 연관성은 H. pylori 감염 과 위축성 위염을 모두 앓은 일본인 대상자에서만 관찰되었습니다(HR, 2.87 [1.14-7.24]) [ 179 ]. 위암의 식이 위험 요인에 대한 76개의 전향적 코호트 연구에 대한 2015년 메타 분석에서, 일일 소금 섭취량이 5g 증가할 때마다 위암 위험이 12% 증가하는 것으로 나타났습니다[ 146 ] (그림 5).
최근 소금은 부착소(SabA, HopQ)와 철 획득에 관여하는 단백질(FecA2 및 FecA3)을 포함하여 H. pylori 외막 단백질(HOP 계열)을 암호화하는 여러 유전자를 조절하는 것으로 밝혀졌습니다 . H. pylori sabA , hopA 및 hopQ 의 전사 수준은 고염 조건에서 증가하는 반면, H. pylori fecA2 및 fecA3 의 전사 수준 은 고염 조건에서 감소합니다[ 180 ].
8.5. 담배 흡연, 비타민 C 및 H. pylori
담배 흡연은 타르(퀴논-히드로퀴논 라디칼), 시안화물, 중금속(예: 카드뮴, 크롬, 니켈)과 같은 독성 돌연변이 유발 화학물질의 섭취로 인해 위암의 중요한 위험 요소입니다. 방향성 발암 물질, 니트로사민 및 니코틴, ROS/RNS 생성 및 지질 과산화 [ 34 , 180 ]. 니코틴으로 유도된 자유라디칼은 생체막과 반응하여 다중불포화지방산(PUFA)의 산화적 파괴를 일으키고 지질 과산화를 통해 세포독성 알데히드를 생성합니다. 담배 연기에서 생성된 티오시아네이트는 타액으로 분비되어 산성 위, 특히 위 심장에서 화학적 니트로산화를 증가시킵니다. EPIC 연구에서는 위심장 선암종(OR = 4.1)을 포함한 흡연으로 인한 위험이 73~87% 증가하는 것으로 나타났습니다. 이 위험은 흡연 강도와 기간에 따라 증가합니다. 흡연은 또한 비심장성 위선암종의 위험 인자였습니다(OR = 1.94) [ 181 ].
EPIC 연구에서는 흡연이 남성과 여성 모두에게 위험 요인인 것으로 나타났지만 Zaridze et al. 흡연은 남성의 위암 발병 위험을 증가시켰지만 여성의 경우에는 증가하지 않은 것으로 나타났습니다 [ 181 , 182 ]. 이 연구는 또한 용량 반응 관계를 보여주었으며, 팩 연도 이력이 높은 환자는 더 큰 위험에 처해 있습니다. Koizumi 등이 수행한 일본 연구에서. [ 183 ], 위암 위험은 흡연을 중단한 후에도 14년 동안 지속되었습니다. Valavanidiset al. [ 184 ] 위암의 11%가 흡연과 관련이 있다고 제안했습니다. 과일 섭취는 비흡연자에서 총 혈장 항산화 수준을 증가시켰지만 흡연자에서는 그렇지 않았습니다. 이는 비타민 C 보호 효과가 흡연으로 인해 약화되었음을 나타냅니다. 그러나 Bohn et al. 흡연자에서도 항산화 물질이 풍부한 식품을 섭취하면 항산화 수준이 향상되는 것으로 나타났습니다 [ 185 ]. 흡연이 위암을 촉진하는 메커니즘 중 일부에는 프로스타글란딘(PGE2) 생성 및 위 점액 무결성 [ 186 ], GSH 및 위 내 비타민 C 수준 [ 187 ]의 보호 효과 감소가 포함됩니다. Gonzalezet al. [ 188 ] 흡연자는 H. pylori 감염 발생률이 더 높았 으며 이는 위 내강 비타민 C가 낮기 때문에 발생하거나 이에 기여할 수 있습니다 [ 187 ]. 왕 외. [ 189 ] 담배 연기에 노출되었을 때 쥐의 위 점막에서 ROS가 증가한 것으로 나타났는데, 이는 흡연이 자유 라디칼 생성과 흡수를 증가시켰다는 것을 의미합니다. 흡연은 비흡연자에 비해 위 상피 이형성증 위험을 두 배로 증가시키며[ 190 ] 위 심장 부위에서 위험이 가장 큽니다[ 181 ].
담배 흡연과 H. pylori 감염은 위암 발생에 상승작용을 일으킬 수 있습니다. 흡연과 H. pylori 상태와 위암 위험 의 연관성에 대한 최근 전향적 연구가 중국, 일본, 한국에서 1,446명의 비심장성 위암 사례와 1,796명의 대조군을 대상으로 수행되었습니다. 현재 흡연과 H. pylori 혈청 양성은 비심장성 위암 위험을 증가시키는 것으로 나타났습니다 (OR = 1.46; 95% CI, 1.10–1.93). 반면 H. pylori 혈청 음성 에서는 위암 위험이 증가하지 않는 것으로 나타났습니다. 현재 흡연자(OR = 0.93; 95% CI, 0.65–1.33) [ 191 ].
Jaroszet al. [ 187 ] 네 그룹으로 나누어진 86명의 폴란드 피험자를 대상으로 분광 광도법을 사용하여 혈장 및 위액의 총 비타민 C 수치를 측정했습니다.
-
비흡연자/ H. pylori 음성: 평균 위 비타민C = 17.1mcg/mL,
-
비흡연자/ H. pylori 양성: 평균 위 비타민C = 12.6mcg/mL,
-
흡연자/ H. pylori 음성: 평균 위 비타민 C = 5.8 mcg/mL,
-
흡연자/ H. pylori 양성: 평균 위 비타민C = 3.9mcg/mL.
위액 내 비타민 C 농도는 비흡연자에 비해 흡연자에서 유의하게 낮았으며( p < 0.05), 흡연자의 H. pylori 감염은 위 내강 비타민 C 수치가 가장 낮은 것과 관련이 있었습니다[ 187 ]. Pasupathi[ 34 ]는 니코틴, 니트로사민, 타르 및 기타 돌연변이 유발 독소를 함유한 담배 연기를 섭취하면 산화 손상이 증가하고 비타민 C, 비타민 E, 글루타티온 및 β-카로틴과 같은 항산화제의 효과가 약화된다고 제안했습니다.
흡연자는 다음과 같은 이유로 비흡연자보다 비타민 C 수치가 낮을 수 있습니다.
-
담배 연기/타르에 노출된 위와 기타 조직의 ROS 및 산화 스트레스에 의한 아스코르빈산의 DHA 소비.
-
비타민 C는 담배 연기에서 활성산소와 ROS를 제거하는 동안 직접 산화된 비타민 E, 베타카로틴 또는 글루타티온의 재생에 사용됩니다.
-
흡연자는 비타민 C 함유 식품의 섭취량이 적습니다.
-
담배 연기로 인한 단백질의 산화적 손상과 지질의 과산화는 조직 아스코르베이트 수준의 현저한 감소를 동반합니다.
-
흡연자 대 비흡연자에서 H. pylori 감염이 증가했습니다 .
-
GSH 의존성 환원효소에 의한 DHA로부터 아스코르베이트 재생 실패.
따라서 아스코르빈산 보충의 보호 효과는 H. pylori 제균 후 또는 흡연 중단 후 흡연자에게서만 나타날 수 있습니다. 담배 흡연으로 인해 생성되는 높은 수준의 자유 라디칼, 지질 과산화, 티오바르비투르산, NDMA 및 F2-이소프로스탄에 대응하기 위해서는 비교적 많은 양의 비타민 C가 필요합니다( 상자 1 ) [ 34 ].
8.6. 술
음주는 위암의 위험인자입니다. 1987년부터 2016년까지 발표된 23개의 전향적 코호트 연구에 대한 2017년 메타 분석에서, 하루에 알코올을 10g씩 섭취할 때마다 위암 위험이 7% 증가했습니다(95% CI 1.02–1.12; I 2 = 28.9%, p = 0.002). 저자들은 H. pylori 상태 와 관련하여 알코올 소비와 위암의 상대적 위험을 조정한 위암에서의 알코올 소비에 대한 단 하나의 연구가 있었다고 언급했습니다 [ 192 ].
EPIC 연구에서는 과도한 알코올 섭취(>60g/일)가 비심장성 장형 위암 위험을 증가시키는 것으로 나타났습니다(OR = 1.65). 이는 중국과 러시아 연구의 증거에 의해 뒷받침되었습니다. Maet al. 과음(주 7회) 및 폭음(회당 알코올 섭취량 55g 초과)은 위험이 3.48배(95% CI, 1.13~10.73) 및 3.27배(95% CI, 1.01~10.56) 더 높은 것으로 나타났습니다. H. pylori 음성 대상자 에서 . H. pylori IgG 혈청양성 환자의 경우 음주습관과 위암 위험 사이에는 유의한 연관성이 발견되지 않았다[ 193 ].
Zaridzeet al. [ 182 ] 800명 이상의 피험자로 구성된 사례 대조 연구에서 독주, 특히 보드카 소비가 남성의 위심장암 위험(OR= 3.4, CI = 1.2-10.2)과 여성의 비심장암 위험을 증가시키는 것으로 나타났습니다( 또는 = 1.5, CI = 1.0–2.3). 보드카 섭취는 H. pylori 감염에 음성 또는 양성인 피험자에서 H. pylori 감염이 없는 피험자에 비해 각각의 위암 위험을 2.0배(95% CI, 1.2~3.1) 및 2.3배(95% CI, 1.4~3.7) 증가시켰습니다. - 술을 마시는 상대. Moyet al. [ 194 ] 391명의 피험자에서 하루 50g 이상의 알코올을 섭취하면 위암 위험이 증가하는 것으로 나타났습니다(HR = 1.4). 알코올의 대사산물(아세트알데히드 및 아세테이트)은 위 점막에 직접적인 독성 영향을 미치고 담배 연기를 포함한 니트로사민의 흡수를 증가 시킵니다 . 1984년부터 2002년까지 노르웨이 피험자 69,962명을 대상으로 한 전향적 인구 기반 연구에서 담배(>20/일)와 알코올(>5회/14일)을 함께 사용하면 비심장성 위선암종의 위험이 거의 5배 증가했습니다. (HR = 4.90, 95% CI = 1.90–12.62). H. pylori 의 교란효과는 본 연구에서는 알려지지 않은 요인이었다[ 196 ].
알데히드 탈수소효소 2 계열 구성원( ALDH2) 유전자의 다형성은 전혀/희소한 소비자에 비해 현재 또는 이전에 알코올을 섭취한 한국 인구 집단에서 위암 위험을 증가시키는 것으로 입증되었습니다. 이는 특히 ALDH2 *1/*2 캐리어[ 5 ] 에서 그러했습니다 .
9. 가족력과 유전적 돌연변이
다양한 환경적, 유전적 요인으로 인한 게놈 불안정성은 미소부수체 또는 염색체 불안정성을 특징으로 합니다. 4.2보다 큰 게놈 변화는 위암의 상당한 위험을 초래한다고 제안되었습니다[ 197 ]. Gonzalezet al. 위암과 연관되는 XPG , PLCE1 , HFE , ERCC5 , EZH2 , DOC2 , CYP19A1 , ALDH2 및 CDH1 을 포함한 유전자의 돌연변이가 확인되었습니다 [ 198 ]. 위암의 위험은 다음과 같은 가족성 암 증후군이 이미 있는 대상에서 더 높습니다.
-
유전성 미만성 위암( CDH1 생식계열 돌연변이)
-
유방암 증후군(BRCA2)
-
유전성 비용종증 대장암(HNPCC, Lynch II) 증후군(MSH2/MLH1/MSH6 돌연변이),
-
리 프라우메니 증후군(TP53 돌연변이)
-
가족성 선종성 용종증(FAP) 증후군(APC 돌연변이).
CDH1 돌연변이가 음성인 유전성 미만성 위암 환자의 경우 BRCA2 , STK11 (세린/트레오닌 키나제 11, 포이츠-제거스 증후군), ATM (운동실조-모세혈관확장증 돌연변이), SDHB (숙신산 탈수소효소 )를 포함한 다른 생식 세포 돌연변이가 발견되었습니다. 복합 철 황 소단위 B), PRSS1 (세린 프로테아제 1, 유전성 췌장염 증후군), MSR1 (대식세포 제거제 수용체 1), CTNNA1 (카테닌 알파 1) 및 PALB2 (BRCA2의 파트너 및 국소화 장치) [ 5 , 12 ].
9.1. 나트륨 의존성 아스코르브산 수송체
나트륨 의존성 아스코르브산 수송체의 돌연변이는 위암 위험 증가와 관련이 있습니다. 용질 캐리어 패밀리 23 멤버 1( SLC23A1 ) 및 SLC23A2 는 각각 SVCT1 및 SVCT2를 인코딩하는 유전자입니다. Wrightet al. SLC23A1 및 SLC23A2 에서 단일 염기 유전자 다형성이 낮은 혈청 아스코르브산 수치를 초래하고 위암 발병률이 41% 증가하는 것과 관련이 있음을 발견했습니다[ 199 ]. 또 다른 연구에서는 SLC23A2 다형성이 위암과 관련이 있었지만 SLC23A1 다형성은 그렇지 않은 것으로 나타났습니다[ 200 ].
9.2. 글루타티온과 위암
중요한 글루타티온 경로의 유전적 이상도 위암 위험을 증가시킵니다. Zhang et al. [ 201 ] 글루타티온 형성에 중요한 효소인 글루타티온 S-트랜스퍼라제 P1(GSTP1)을 발현하는 유전자의 돌연변이가 위암 발병 위험을 높인다는 사실이 밝혀졌습니다. GSTP1 유전자 의 가장 일반적인 다형성은 뉴클레오티드 313의 A-->G이며, 이는 아미노산(Ile105Val)의 치환을 초래하는 돌연변이입니다. GSTP1 치환 돌연변이 가 있는 환자에서는 위암 위험이 더 높았는데 , 이는 글루타티온 수치가 낮을수록 위암 위험이 증가한다는 것을 보여줍니다. GSTP1 돌연변이 가 있는 피험자는 흡연(OR = 1.64), 알코올(OR = 1.64) 또는 H. pylori 감염(OR = 3.7) 으로 인해 위암에 대한 추가 위험이 있었습니다 . GSTP1 의 CpG 과메틸화는 EBV 관련 위암(20%)에서 흔히 발견되는 후생적 변형이지만, EBV 음성 위암에서는 드물다(0.4% ) .
글루타티온과 관련된 다른 중요한 돌연변이로는 GSTT1 및 GSTM1 의 다형성이 있습니다 . GSTT1은 세포질, 미토콘드리아 및 마이크로솜의 화합물을 해독하기 위해 글루타티온에 의한 독소의 접합에 중요합니다. 접합을 통해 신체는 소변이나 담즙을 통해 독소를 신체 밖으로 배출할 수 있습니다. GSTT1 (22q11.2)의 null 대립유전자 다형성은 글루타티온에 의한 독소의 접합을 방지하기 때문에 위암 위험을 증가시키는 것으로 입증되었습니다 . GSTM1은 글루타티온을 합성하고 재활용합니다. GSTM1 의 다형성은 또한 위암 위험을 증가시키는 것으로 나타났습니다. GSTM1을 포함한 GST 계열 구성원은 담배 연소로 인해 생성된 발암 물질과 알코올 대사 산물의 해독에 필요합니다. GSTT1 과 GSTM1 모두에 돌연변이가 있는 환자는 야생형 유전자형이 모두 있는 환자에 비해 위암 위험이 유의하게 증가했습니다(OR = 1.95, 95% CI: 1.42–2.67; I 2 = 0%) [ 202 , 203 ].
10. 위 MALT 림프종 및 H. pylori 제균
위 MALT 림프종의 대부분(92%)은 H. pylori 감염과 관련이 있는 것으로 나타났습니다[ 204 ]. 위 MALT 림프종과 관련된 H. pylori 균주는 vacA m2 대립유전자를 함유하고 cag 병원성 섬(cagPAI)이 없다는 점에서 위 선암종과 관련된 균주보다 독성이 덜합니다. CagA 양성 균주는 미만성 거대 B세포 림프종(DLBCL)과 연관될 가능성이 더 높습니다 [ 205 ]. 변연부 B 세포 림프종은 위 점막에서 발생하며 전위 t(11;18)(q21;q21)이 있는 것으로 흔히 발견됩니다. 이는 실제로 치료에 대한 반응이 좋지 않을 것으로 예측합니다. 헬리코박터 제균 만으로 위 MALT 림프종의 완전 관해(CR)가 H. pylori 양성 환자의 최대 85%에서 보고되었습니다 . 흥미롭게도 H. pylori 음성 인 환자 도 위 MALT 림프종에 대한 항생제 치료에 반응할 수 있으며 최대 57%의 CR을 달성할 수 있습니다. 헬리코박터 박멸은 MALT 단계나 골수 침범 여부에 관계없이 성공적이었습니다. MALT 림프종 재발은 CR 후 몇 년 후에 발생할 수 있으며, 위암 발생 위험 때문에 내시경 감시가 권장됩니다[ 204 , 205 , 206 , 207 , 208 , 209 , 210 , 211 , 212 , 213 ].
11. H. pylori 제균을 통한 위암 예방
11.1. 헬리코박터 파일로리 박멸과 위암
H. pylori 를 성공적으로 근절하면 무증상 H. pylori 양성 개인(통합 발병률 비율, 0.62; 95% CI: 0.49~0.79)과 조기 위암의 내시경 절제술 후 위암 발생률이 크게 감소합니다. (통합 발생률 비율, 0.46; 95% CI: 0.35–0.60) [ 213 ]. 21개 RCT에 대한 2016년 메타 분석에서 H. pylori 제균은 위암의 기본 발생률 증가와 함께 비선형 방식으로 위암의 통합 발생률을 감소시켰습니다( p = 0.018) [ 214 ]. H. pylori 제균을 통한 원발성 위암 예방에 대한 7개의 RCT에 대한 2017년 메타 분석에서는 전반적인 상대 위험도가 0.67(95% CI: 0.48~0.95)로 유사한 감소를 보였습니다. 그러나 각각의 전체 위험차(RD)는 0.00([95% CI: -0.01~0.00], 치료에 필요한 횟수는 125.5[95% CI: 70.0~800.9])이었다. 통합상대위험도(RR)와 RD의 차이는 희귀사건 데이터를 사용하고 상대위험도가 실제 효과를 과대평가했기 때문으로 생각된다[ 215 ].
31개 RCT에 대한 추가 2019년 메타 분석에서는 동아시아에서 H. pylori 제균(OR = 0.46) 후 향후 위암이 크게 감소한 것으로 나타났습니다 . 하위 집합 분석에서 이 효과는 일본인(OR = 0.39)과 한국인(OR = 0.47) 환자에서 가장 두드러졌습니다[ 216 ]. 위 선암종 예방 이상의 H. pylori 제균 의 다른 유익한 효과 로는 소화성 궤양 질환 감소, MALT 림프종, 기능성 소화불량, 위축성 위염, 비타민 B12 및 철분 결핍, 특발성 혈소판 감소증 자반증 등이 있습니다. 풍토병 국가에서 H. pylori 박멸 의 잠재적 이점으로 인해 2004년 대만과 2013년 일본에서 인구 기반 테스트가 시작되었습니다[ 4 ].
인구 기반 H. pylori 검사를 위암 발병률이 낮은 국가로 확대하는 것은 논란의 여지가 있습니다[ 217 ]. 선진국에서는 H. pylori 균주 독성과 식이 및 환경 위험 요인에 차이가 있습니다. 현대 지침에서는 H. pylori 에 감염된 것으로 밝혀진 환자를 치료해야 한다고 권장합니다. 이는 잠재적으로 항생제 내성 위험을 증가시키고, 위장관 미생물학을 변화시키거나 비용을 증가시킬 수 있습니다. 371,813명의 증상이 있는 미국 재향군인을 대상으로 진단된 H. pylori 에 대한 후향적 코호트 연구가 최근 보고되었습니다[ 218 ]. 성공적인 제균은 요소 호흡 검사, 대변 항원 검사 또는 대변 항원 검사에서 입증된 H. pylori 감염 환자 38,535명에서 비심장성 위암의 향후 위험을 76%(SHR, 0.24; 95% CI, 0.15–0.41; p < 0.001) 감소시켰습니다. 조직 병리학. 근절은 이들 환자의 75%(28,818/38,535)에서만 시도되었으며, 이는 의도치 않게 결과를 비교할 수 있는 치료되지 않은 환자의 하위 그룹을 제공했습니다. H. pylori 감염 진단 후 5년, 10년, 20년에 치료를 받지 않은 환자의 전체 위암 발생률은 각각 0.37%, 0.5%, 0.65%로 상대적으로 낮았습니다 . 그러나 백인 환자에 비해 흑인(SHR, 2.0), 히스패닉(SHR, 1.59), 아시아인(SHR, 2.52) 인종이나 민족의 경우 위암 발생 위험이 더 높았다. 남성, 노령(SHR, 1.13), 흡연(SHR, 1.39)도 추가적으로 중요한 위험인자였다[ 218 ].
연구의 한계 중 하나는 H. pylori 치료를 받은 환자 28,818명 중 8020명(28%)만이 치료 후 검사를 받았다는 것입니다. 이 중 90.9%(7292/8020)가 성공적으로 박멸되었습니다. 이 연구는 전체적인 위암 발병률은 낮지만 일부 인구통계학적 하위 그룹에서는 위험이 더 높은 서구 국가에서 인구 기반 H. pylori 검사 에 대한 향후 결정을 내릴 수 있는 정보를 제공할 수 있다고 생각되었습니다 [ 218 ]. 현 시대에 H. pylori clarithromycin과 메트로니다졸 내성이 있는 H. pylori 제균을 확인하기 위한 치료 후 검사가 강조됩니다. 이는 전향적 연구에서 헬리코박터 치료 의 예방 효과가 희석되지 않도록 하기 위함이다 [ 219 ].
11.2. H. pylori 박멸, 장화생 및 위암
인구 기반 H. pylori 제균 과 비교하여 위암 전암성 변화가 발생하기 전의 고위험 환자에 대한 보다 표적화된 접근 방식은 잠재적으로 위암 예방에 더 효과적일 수 있습니다. 조기에 성공적인 H. pylori 제균은 위축성 위염의 퇴행으로 이어질 수 있지만 장상화생은 확립되지 않았습니다[ 74 , 219 , 220 ]. 예를 들어, 1676년 H. pylori 양성인 한국 위암 환자의 1촌 친척에 대한 H. pylori 제균 의 예방 효과는 최근 이중 맹검, 위약 대조 시험에서 보고되었으며 중앙 추적 기간은 9.2년이었습니다. H. pylori 감염이 성공적으로 근절된 참가자의 5/608(0.8%) 과 지속적인 감염이 있었던 참가자의 28/979(2.9%)에서 위암이 발생했습니다(HR, 0.27; 95% CI, 0.10~0.70). [ 221 ]. H. pylori 제균이 확립된 IM 환자의 장기간 추적 관찰 후 향후 위암 발병 위험을 개선하지 못할 수 있다는 관찰은 AG 및 비IM 환자에서 H. pylori 제균에 의해 CIMP가 감소한다는 발견에 의해 뒷받침됩니다. 점막이지만 IM에서는 그렇지 않습니다. CIMP 발병률은 또한 Correa 경로의 조직학적 변화와 병행하여 AG에서 위암으로 진행되는 것으로 보입니다[ 222 ] (그림 5). 그러나 IM이 위암 예방에 있어서 "돌이킬 수 없는 지점"이라는 개념은 특히 Shandong Intervention 재판의 최근 보고에서 여전히 논쟁의 여지가 있습니다[ 214 , 223 ].
11.3. 산둥 개입재판
Shandong Intervention Trial은 초기 위내시경 검사와 H. pylori 혈청학적 검사를 받은 3,365명의 참가자를 대상으로 한 맹검, 무작위, 위약 대조 위암 예방 시험이었습니다 [ 223 ]. 이 연구는 1995년에 시작되어 위암 사망률이 높은 중국 북부 산동성 Linqu 카운티에서 실시되었습니다(남성 55/10 5명 , 여성 19/10 5 명). Linqu 현에서는 또한 H. pylori 감염률 이 높고 비타민 C와 셀레늄 결핍이 발생하고 있습니다. 이 연구에서는 H. pylori 제균(2주 동안 오메프라졸 및 아목시실린) 및/또는 경구 비타민 C 250mg, 비타민 E 100IU, 셀레늄 37.5μg(7.3년 동안 복용) 및/또는 마늘 보충제 의 장기적인 효과를 평가했습니다. 또는 2258명의 H. pylori 혈청 양성 환자의 위암 발생에 대한 위약(7.3년 동안 복용)을 2 × 2 × 2 요인 설계로 적용했습니다. 이는 비타민 및/또는 마늘 보충제 또는 위약을 투여받은 1107명의 H. pylori 혈청음성 사람들과 2×2 요인 설계 로 비교되었습니다 . 1996년 후속 요소 13C 호흡 검사에서 원래 혈청 양성 반응을 보인 참가자 2,258명 중 382명(17%)이 지속적인 H. pylori를 갖고 있는 것으로 나타났으며 , 이들은 추가로 2주간의 헬리코박터 박멸 요법을 받았습니다[ 223 ].
2019년에 연구 그룹은 22.3년간의 추적 결과를 보고했는데, 그 결과 H. pylori 제균 치료가 위암 발병률을 유의하게 감소시키는 것으로 나타났습니다(OR, 0.48, 95% CI: 0.32–0.71, p < 0.001). 위암 발병률도 비타민 보충제(OR, 0.64, 95% CI: 0.46–0.91, p = 0.01)에서는 유의하게 감소했지만 마늘 보충제(OR, 0.81, CI: 0.57–1.13, p = 0.22) 에서는 그렇지 않았습니다 . 세 가지 중재 모두 위암 사망률이 통계적으로 유의하게 감소한 것으로 나타났습니다. H. pylori 제균 HR = 0.62(95% CI: 0.39~0.99, p = 0.05), 비타민 보충 HR = 0.48(95% CI: 0.31~0.75, p = 0.001) ), 마늘 보충 HR = 0.66(95% CI: 0.43~1.00, p = 0.05). 위험 비율은 기본 조직학(중등도 만성 위축성 위염 또는 덜 심각한 위 병변, 심각한 만성 위축성 위염 또는 표재성 장화생, 심부 장화생 또는 이형성), 연령, 성별, 음주 이력 및 흡연 이력에 대해 조정되었습니다. . 위암 발병률과 사망률에 대한 H. pylori 제균 의 유익한 효과는 노인 환자(55~71세)와 기본 내시경 평가에서 장상화생증 및 이형성증이 있는 환자에게서도 분명했습니다. 위암 및 위암 사망률에 대한 비타민 보충의 예방 효과는 젊은 환자(<45세) 또는 더 유리한 기저 조직학(정상, 표재성 위염, 만성 위축성 위염) 환자에서 더 분명했습니다. 혈청 반응 양성 환자에서 H. pylori 제균 과 비타민 보충을 병용하면 위암 발병 OR = 0.30(95% CI: 0.16–0.55) 및 위암 사망률 HR = 0.31(95% CI: 0.15–0.66) 예방에 시너지 효과가 있는 것으로 나타났습니다. 마늘 투여와 H. pylori 제균 의 결합 효과 도 위암 발생에 대한 개별 효과보다 컸습니다 OR = 0.38(95% CI: 0.21~0.69), 위암 관련 사망률 HR = 0.44(95% CI: 0.23~ 0.84) [ 223 ].
전암성 점막 변화의 퇴행과 암 진행 예방을 위해 긴 발암물질 제거 기간이 필요하다는 사실은 위암과 헬리코박터 펠리스 에 대한 마우스 연구 , 위암과 헬리코박터 파일로리 에 대한 몽골 게르빌 연구, H 에 대한 임상 연구에 의해 뒷받침됩니다. .파이로리 박멸. 이러한 연구들은 헬리코박터 조기 제균이 위암 예방에 더 효과적이라는 것을 보여주며, 헬리코박터 초기 제균 이후에는 중단 없이 장기간의 항산화 보호(비타민 C, 비타민 E, β-카로틴, 셀레늄)가 필요함을 보여주었다[ 134 , 223 ]. 장상화생에서 위장 이형성으로의 진행은 젊은 환자(각각 100인년당 4.0대, 각각 2.1/100인년)보다 노년층 환자(>40세)에서 더 빠른 것으로 보입니다. Correa는 주요 발암 물질( H. pylori ) 을 제거한 후 위암 발생 위험이 감소하는 것을 시그모이드 2차 곡선을 따라가며 위암 발생의 진행성 Correa 경로와 평행하게 진행된다고 설명했습니다[ 134 ].
12. 결론
위암 발생은 유전적 감수성, 환경 요인, H. pylori 박테리아 및 Epstein Barr 바이러스 감염 및 후생유전학을 포함하는 다인자 및 다단계 과정입니다 . 항산화 시스템과 섭취된 식물성 화학 물질은 산화 스트레스, 섭취된 발암 물질, 돌연변이 유발 물질 및 만성 헬리코박터 파일로리 감염 으로부터 위 상피 세포를 보호할 수 있습니다 . 아스코르빈산은 활성 비타민 E와 글루타티온을 재생하고, 내인성 N-니트로소화를 억제하고, 섭취된 아질산염, 니트로사민 및 헤테로고리 아민의 체세포 돌연변이 유발 효과를 감소시키고, ROS로 인한 손상을 억제하고 H. pylori를 예방함으로써 항산화 효과를 통해 위암을 예방할 수 있습니다. 감염(또는 박멸 후 재감염). 아스코르브산은 또한 DNA 억제 유전자의 탈메틸화에 중요한 보조 인자입니다.
헬리코박터 제균, 위험 감소 및 위 세포 보호를 통해 만성 위축성 위염 및 장상화생이 위암으로 진행되는 것을 예방하는 것이 가능할 수 있습니다 . 헬리코박터 파일로리 관련 위 장화생 의 "복귀 불능 지점"은 고위험군에 대한 H. pylori 박멸 프로그램 의 시기에 중요할 수 있습니다 . 위 세포 보호의 효과는 H. pylori 균주 , 특히 CagA 아형의 독성과 밀접한 관련이 있습니다. 위암의 장내 아형과 미만성 아형 모두 H. pylori 위염, 혈액형 A, 흡연, 알코올 섭취 등의 위험 요인을 공유합니다. 그러나 미만성 위암에서는 유전학(예: CDH1 생식계열 돌연변이)과 여성의 성별이 중요합니다. 최근 전사체 및 단백질체학 분석을 통해 위암은 종양 내, 환자 내, 환자 간 변동성이 큰 복잡하고 이질적인 질병이라는 것이 입증되었습니다. H. pylori 의 박멸은 위 상피에 의한 비타민 C 분비의 회복을 유도하고 전암성 위 병변의 퇴행을 가능하게 하여 위암 발생의 Correa 경로를 방해할 수 있습니다.
약어
| 5-FU | 5-플루오로우라실 |
| α-KGDD | α-케토글루타레이트 의존성 디옥시게나제 |
| AG | 위축성 위염 |
| 나이 | 고급 당화 최종 생성물 |
| AGS | 인간 위 선암종 과다배체 세포주 |
| ALDH2 | 알데히드 탈수소효소 2 계열 구성원 |
| 에일 | 고급 지질 과산화 최종 생성물 |
| 알파 | 부착 관련 지질단백질 A |
| Akt | 단백질 키나제 B |
| 아파 | 항 정수리 세포 항체 |
| APC | 선종성 폴립증 대장균 단백질 |
| ATP | 아데노신 삼인산 |
| 바바 | 혈액형 항원 결합 부착인 |
| BCL-2 | B세포 림프종-2 |
| 브라카 | 유방암 감수성 유전자 |
| 카가 | 세포독소 관련 유전자 A |
| 고양이 | 카탈라아제 |
| CD | 차별화 클러스터 |
| CDH1 | E-카드헤린 유전자 |
| CDH1 | E-카드헤린 단백질 |
| CDKN2A | 사이클린 의존성 키나제 억제제 2A |
| CDX | 꼬리형 호메오박스 |
| CEACAM | 암배아 항원 관련 세포 접착 분자 |
| CIMP | 시토신 및 구아닌(CpG) 섬 메틸화 표현형 |
| CIN | 염색체 불안정성 |
| 콕스 | 시클로옥시게나제 |
| Csk | C 말단 Src 키나제 |
| CTGF | 결합 조직 성장 인자 또는 CCN2 |
| CXCL2 | CXC 케모카인 리간드 2 또는 대식세포 염증성 단백질 2-알파(MIP) |
| CXCR4 | CXC 케모카인 수용체 유형 4 |
| DGC | 미만성 위암 |
| DHA | 데히드로아스코르브산 |
| dMMR | 부족한 불일치 수리 |
| EBV | 엡스타인-바 바이러스 |
| EGFR | 표피 성장 인자 수용체 |
| 응급구조 | 상피 중간엽 전이 |
| 에녹 | 내인성 니트로사민 |
| 에피야 | 글루타메이트-프롤린 이소류신티로신-알라닌 |
| EPO | 에리스로포이에틴 |
| erbB2 | 인간 표피 성장 인자 수용체 유전자 |
| ERK | 세포외 신호 조절 키나아제 |
| etv4 ets | (적아세포 형질전환 특이적) 변종 전사 인자 4 |
| FAK | 국소 접착 키나제 |
| FAP | 가족성 선종성 폴립증 |
| FGFR4 | 섬유아세포 성장인자 수용체 유전자 |
| GGT | γ-글루타밀 트랜스펩티다아제 |
| 과다 | 막 포도당 수송체 |
| GPX | 글루타티온 퍼옥시다제 |
| GSH | 글루타티온 |
| GSTM1 | 글루타티온 S-트랜스퍼라제 Mu 1 |
| GSTP1 | 글루타티온 S-트랜스퍼라제 Pi 1 |
| GSTT1 | 글루타티온 S-트랜스퍼라제 세타 1 |
| HBD | 인간 β-디펜신 |
| HCA | 헤테로사이클릭 아민 |
| HER2 | 인간 표피 성장 인자 |
| HGF-R | 간세포 성장 인자 수용체 유전자, c-MET |
| HIF-1α | 저산소증 유발 인자-1 알파 |
| 홍콩 | 헥소키나제 |
| HKalpha | 벽세포 양성자 펌프의 알파 하위단위 |
| HMX1 | 헴산화효소-1 |
| hMLH1 | 인간 MutL 동족체 1 |
| HNO 2 | 아질산 |
| HNPCC | 유전성 비용종증 대장암 |
| HOCl | 차아염소산 |
| 홉Q | 헬리코박터 파일로리 외부 단백질 Q |
| HP 낮잠 | 헬리코박터 파일로리 호중구 활성화 단백질 |
| HRE | 저산소증 반응 요소 |
| H2O2 | 과산화수소 |
| Htra | 세린 프로테아제 고온 요구 사항 A |
| HSP | 열충격 단백질 |
| IFN | 인터페론 |
| IGFBP3 | 인슐린 유사 성장 인자 결합 단백질 3 |
| IκBα | 활성화된 B 세포 억제제, 알파의 핵 인자 카파 경쇄 강화제 |
| 이노스 | 유도성 산화질소 합성효소 |
| 일리노이 | 인터루킨 |
| ILK | 인테그린 연결 키나제 |
| 나는 | 장상화생 |
| JHDM | Jumonji-C 도메인 함유 히스톤 탈메틸화효소 |
| JNK | c-Jun N-말단 키나제 |
| 크라스 | Kirsten 쥐 육종 바이러스 종양 유전자 |
| LDH | 젖산염 탈수소효소 |
| 액체 산소 | 리실산화효소 |
| L-굴로 | L-굴로노-감마-락톤-산화효소 |
| LPS | 지질다당류 |
| 맥아 | 점막 관련 림프 조직 |
| MAP3K | 미토겐 활성화 단백질 키나제 |
| MDA | 말론디알데히드 |
| 관리 | O-6-메틸구아닌 DNA 메틸트랜스퍼라제 효소 |
| MHC | 주요 조직 적합성 복합체 |
| MMP | 매트릭스 메탈로프로테아제 |
| MSI | 미세위성 불안정성 |
| MSS | 미소위성 안정 |
| mTOR | 라파마이신의 포유류 표적 |
| NAC | N-아세틸 시스테인 |
| NDMA | 니트로소디메틸아민 |
| NF-κB | 활성화된 B 세포의 핵인자 카파 경쇄 인핸서 |
| 아니요 | 산화질소 |
| NOx | NADPH 산화효소 |
| OipA | 외부 염증성 단백질 A |
| PAMP | 병원체 관련 분자 패턴 |
| PDK1 | 피루베이트 탈수소효소 키나제 1 |
| PDGFβ | 혈소판 유래 성장 인자 베타 |
| PD-L1 | 프로그램된 사망 리간드 1 |
| PGE2 | 프로스타글란딘 E2 |
| PGK | 인산글리세레이트 키나제 |
| PGN | 펩티도글리칸 |
| PHD | 프롤릴 수산화효소 |
| PKM2 | 피루베이트 키나제 근육 동종효소 2 |
| PPI | 양성자 펌프 억제제 |
| PTEN | 포스파타제 및 텐신 동족체 |
| 푸파 | 다중불포화지방산 |
| pVHL | 폰-히펠-린다우 단백질 |
| 격노 | 고급 당화산물의 수용체 |
| 로아 | Ras 상동체 가족 구성원 A |
| 약간 뒤틀리게 하다 | 수용체 상호작용 단백질 세린-트레오닌 키나제 2 |
| RNS | 반응성 질소 종 |
| 로스 | 활성산소종 |
| 사바 | 시알산 결합 접착제 |
| SFK | Src 계열 키나제 |
| SH2 | Src 상동성 2 |
| 배송2 | Src 상동성 2 이노시톨 포스파타제 |
| SIRT3 | [시르투인(자동 교배형 정보 규정 2 상동체) 3] |
| SLC23A1 | 용질 캐리어 패밀리 23 멤버 1 |
| 강타 | 징크핑거 단백질 SNAI2 |
| 잔디 | 과산화물 제거효소 |
| SOX2 | 성별 결정 영역 Y-박스 2 |
| 달팽이 | 징크핑거 단백질 SNAI1 |
| SPEM | 화생을 발현하는 진경성 폴리펩티드 |
| 소스 | 비수용체 관련 육종 티로신 키나제 |
| STAT3 | 신호 변환기 및 전사 활성제 3 |
| TET | 텐일레븐 전이 |
| TET1 | TET 메틸시토신 디옥시게나제 1 |
| TF | 톰센-프리덴라이히 항원 |
| T4SS | IV형 세균 분비 시스템 |
| TGF-β | 형질전환 성장 인자 베타 유전자 |
| Th1 | T헬퍼 1형 셀 |
| TLR | 유료 유사 수용체 |
| Tlp | 단백질과 같은 변환기 |
| TNF-α | 종양괴사인자-알파 |
| TRAF | TNF 수용체 관련 인자 |
| 자취 | 종양 괴사 인자 세포사멸 유도 리간드 |
| 트레그 | 조절 T 세포 |
| 트위스트1 | 비틀기 기본 나선 루프 나선 전사 인자 1 |
| 휴가 | 공포화 세포독소 유전자 A |
| VEGF | 혈관 내피 성장 인자 |
| VM | 비멘틴 |
| ZEB | 징크핑거 E-박스 바인딩 호메오박스 1 |
저자 기여
개념화, RBW; 방법론, RBW 및 JWTT; 소프트웨어, JWTT; 검증, RBW; 공식 분석, RBW; 조사, RBW 및 JWTT; 자원, RBW; 작문 - 원본 초안 준비, RBW 및 JWTT; 쓰기 - 검토 및 편집, RBW 및 JWTT; 시각화, RBW; 프로젝트 관리, RBW; 자금 조달, RBW 모든 저자는 출판된 원고 버전을 읽고 동의했습니다.
 비타민 C 강화: 캡슐화 기술의 필요성과 최근 동향
비타민 C 강화: 캡슐화 기술의 필요성과 최근 동향
 젊은 뇌의 비타민 C 결핍—실험 동물 모델을 통한 결과 †
젊은 뇌의 비타민 C 결핍—실험 동물 모델을 통한 결과 †