단축키
Prev이전 문서
Next다음 문서
단축키
Prev이전 문서
Next다음 문서
비타민 C는 산화환원 항상성의 독특한 특성으로 인해 다양한 신체 기능에 관여합니다. 더욱이, 비타민 C는 또한 활성 DNA 탈메틸화(TET 단백질), 히스톤의 탈메틸화 및 저산소증 과정에 관여하는 2-옥소글루타레이트 및 Fe 2+ 의존성 디옥시게나제(2-OGDD) 의 활성을 회복하는 데 큰 역할 을 합니다. 따라서 비타민C는 유전자 발현 조절이나 저산소 상태에 관여할 수 있습니다. 따라서 비타민 C는 암 치료에 대한 그럴듯한 효과로 인해 큰 관심을 얻었습니다. 개념화 이후, 암 치료에서 비타민 C의 역할은 논란의 여지가 있는 문제였습니다. 비타민 C는 나트륨 의존성 수송체(SVCT)와 포도당 수송체(GLUT)를 통해 세포로 전달됩니다. 그러나 이러한 수송체의 손상된 기능이 발암 및 종양 진행으로 이어질 수 있는지 여부는 알려져 있지 않습니다. 특히, 이전 연구에서는 SVCT의 다형성 또는 일부 유형의 암에서 변형된 발현을 확인했습니다. 이 리뷰에서는 암에 대한 비타민 C의 잠재적 영향과 손상된 SVCT 기능에 대해 논의합니다. 비타민 C 수송체 유전자의 변이는 비타민 C의 능동 수송을 조절하여 암 위험에 영향을 미칠 수 있지만, 암 생물학에 이들의 관련성을 완전히 밝히기 위해서는 추가 연구가 필요합니다.
1. 비타민C의 성질과 산화환원 항상성
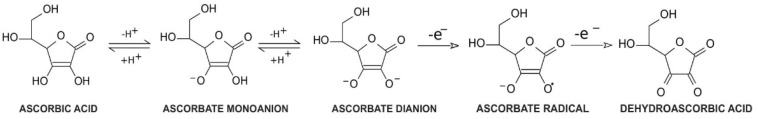
l-아스코르브산 또는 l-아스코르베이트의 일반적인 이름인 비타민 C는 탄소가 6개인 락톤입니다. 이는 인간, 다른 영장류, 박쥐 및 기니피그를 제외한 거의 모든 포유동물의 간에서 발견될 수 있는 효소 l-굴로노-1,4-락톤 산화효소에 의해 포도당으로부터 합성될 수 있습니다[ 1 , 2 ]. 결과적으로, 이들 종은 유기체에 l-아스코르베이트를 외인적으로 제공해야 합니다. l-아스코르베이트는 인체 전반에 걸쳐 존재하는 수많은 효소의 활성을 강화시키는 핵심 요소이기 때문에 비타민C의 외부 섭취가 특히 중요합니다. 아스코르브산의 독특한 특성은 구조 및 생화학과 관련이 있습니다. 아스코르브산은 탄소 2와 탄소 3에 위치한 수산기 그룹에서 하나 또는 두 개의 수소 이온이 분리되어 아스코르브산 모노음이온 또는 아스코르베이트 이음이온으로 변형될 수 있습니다. 생리학적 pH에서 아스코르브산염은 모노음이온으로 기능합니다. , 이것이 기본 형태입니다. 아스코르브산은 두 개의 단일 전자 산화가 쉽게 일어나는 중요한 환원 인자로 알려져 있습니다. 첫 번째는 아스코르베이트 라디칼 생성[ 3 ]을 통해 이루어지며, 안정적이지만 반응성이 높지 않은 형태[ 4 ]의 특정 화학 구조(공명 안정화)를 제공합니다. 아스코르베이트 라디칼은 두 번째 1전자 산화를 거쳐 데히드로아스코르브산(DHA)을 형성할 수 있습니다.그림 1) [ 삼 ]. 이러한 능력으로 인해 아스코르베이트는 더 안정적이고 반응성이 덜한 화합물로 대체되어 다른 자유 라디칼에 대한 특히 우수한 방어자가 됩니다[ 4 ]. 또한, 시험관 내 연구에서는 아스코르브산염의 증가된 수준이 과산화물 제거 시 과산화물 디스뮤타제와 협력하는 자극으로 작용할 수 있음을 보여주었습니다[ 5 ]. DHA와 아스코르베이트 라디칼은 가역적인 방식으로 아스코르베이트로 환원될 수도 있습니다[ 3 ].
환원제로 작용하는 능력에도 불구하고 아스코르베이트는 산화 인자로서 중요한 역할을 수행할 수도 있습니다. 아스코르브산염의 산화 과정은 주로 촉매 금속의 존재 하에서 발생하지만, 이 과정은 아스코르브산염 자체(자가 산화)에 의해 수행될 수 있지만 중성 pH에서는 상당히 느린 속도로 수행됩니다[ 6 ]. 비타민 C 산화의 효과는 과산화수소 형성이며, 이는 세포 내 산화환원 안정성을 변화시켜 세포 대사에 영향을 미칠 수 있습니다[ 6 , 7 ]. 더욱이, 비타민 C는 환원 및 산화 인자 역할을 하는 능력을 통해 전구약물로 작용할 수 있습니다[ 7 ]. 비타민 C의 특권 형태는 혈장 내 비타민 C 농도에 따라 결정됩니다. 생리학적 농도에서 아스코르브산은 항산화 기능을 우선적으로 발휘하여 세포의 2-옥소글루타레이트 및 Fe 2+ 의존성 디옥시게나제 활성(2-OGDDs)을 회복하는 데 도움을 줍니다[ 8 ]. 반면, 아스코르빈산의 수준이 높을수록 산화촉진 기능과 관련이 있습니다[ 7 ].
2. 2-OGDD 효소 활성에서 비타민 C와 그 역할
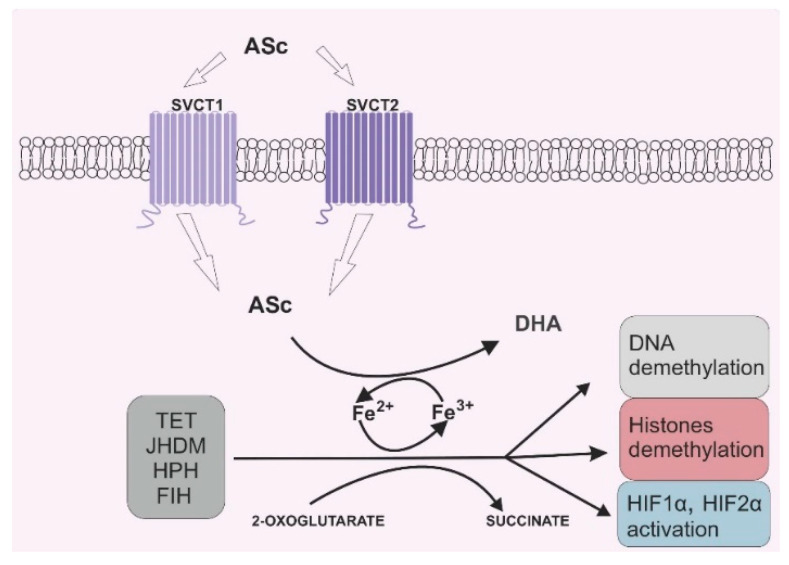
항산화 잠재력으로 인해 비타민 C는 효소 보조 인자 역할을 할 수도 있습니다. 2-OGDD 효소는 촉매 활성을 유지하기 위해 2-옥소글루타레이트(2-OG)와 Fe 2+를 필요로 합니다. 그러나 대부분의 2-OGGD에는 보조인자로서 아스코르베이트가 필요합니다 [ 9 ]. 2-OGDD 계열은 코어에 Fe 2+ 이온이 있는 특정 이중 가닥 β-나선(DSBH) 모티프를 포함하는 60개 이상의 효소로 구성됩니다. 이들의 촉매 기능은 산소 존재 하에서 2-OG의 탈카르복실화를 통해 숙신산염으로 전환되는 특정 기질의 수산화와 관련이 있습니다[ 10 ]. 아스코르브산은 촉매 도메인을 표적으로 삼고 철 이온을 Fe 3+ 에서 Fe 2+ 로 재생함으로써 2-OGGD에 의해 촉매되는 반응 속도를 결정적으로 증가시킵니다 .그림 2) [ 11 ].
지난 10년 동안의 연구에서는 비타민 C가 후생유전학에서 중요한 기능을 가지고 있음이 강조되었습니다. 2009년에 Tahiliani et al. 후성유전학 분야에 새로운 빛을 비추다. 저자들은 원래 급성 골수성 백혈병 환자에서 MLL 및 LCX 유전자(t(10;11)(q22;q23))의 염색체 전좌로 간주되었던 텐-일레븐 전좌 효소(TET: TET1, TET2, TET3)가 12 , 13 ]는 실제로 DNA 메틸화 패턴을 변경하는 역할을 담당합니다[ 14 ]. 그들의 연구에 따르면 TET는 5-메틸시토신(5-mC)의 5-히드록시메틸시토신(5-hmC)으로의 수산화를 유도하여 DNA 탈메틸화를 유도하는 능력이 있는 것으로 나타났습니다[ 14 ]. 이 분야의 이후 개발에서는 TET가 5-hmC의 다른 시토신 유도체로의 추가 수산화에도 관여하며 이후 DNA 글리코실라제에 의해 절단될 수 있음이 밝혀졌습니다[ 15 ]. 많은 연구에서 아스코르베이트가 TET 단백질 활성에 중요한 화합물이라는 사실이 밝혀졌습니다. 왜냐하면 이들 단백질은 2-OGDD 슈퍼패밀리에 속하기 때문입니다. 아스코르브산은 TET 단백질에 의해 제공되는 5-mC의 수산화를 촉진하여 5-hmC 생성을 향상시키는 것으로 입증되었습니다[ 16 ]. 또한, 다른 강력한 산화제는 유사한 활성을 나타내지 않기 때문에 TET 단백질에 대한 아스코르브산의 영향은 환원 능력 때문만이 아니라는 것이 결정적으로 입증되었습니다[ 17 ]. 이러한 발견에 따라 비타민 C는 DNA 탈메틸화를 촉진하는 물질로 제안되었습니다[ 16 , 17 ]. DNA 메틸화와 탈메틸화는 시토신 변형뿐만 아니라 히스톤의 아미노산 변화를 통한 염색질 재구성과도 연관되어 있습니다. 히스톤 탈메틸화를 담당하는 효소는 Jumonji C 도메인 함유 히스톤 탈메틸화효소(JHDM)이며, 이 역시 2-OGDD 슈퍼패밀리에 속합니다[ 18 ]. 문헌 검토에서 언급한 바와 같이, 20개 이상의 JHDM이 히스톤에 위치한 라이신의 메틸 그룹을 제거할 수 있습니다[ 9 , 19 ]. 이전 연구에서는 라이신의 메틸화가 히스톤의 위치에 따라 전사를 유도하거나 억제할 수 있음을 확인했습니다. 히스톤 H3의 리신 9와 히스톤 H4의 리신 20에 위치한 메틸화는 유전자 침묵을 제공하는 반면, 히스톤 H3의 리신 4, 리신 36 및 리신 79의 메틸화는 전사 강화와 관련이 있습니다[ 20 , 21 ]. 암의 시작과 진행 동안 메틸화와 탈메틸화 사이의 손상된 균형의 필수적인 역할을 조사한 대규모의 증거가 증가하고 있습니다[ 22 , 23 , 24 , 25]. 최근 몇 년 동안 다양한 암, 특히 혈액학적 암에서 TET 또는 JHDM 돌연변이에 대한 관심이 증가했습니다[ 26 , 27 , 28 ]. 따라서 암 치료에서 비타민 C의 그럴듯한 효과는 수많은 연구 작업의 중심 목표였습니다.
2-OGDD 계열의 다른 구성원으로는 저산소증 유도 인자인 HPH(프롤릴 수산화효소)와 인자 억제 저산소증 유도 인자(FIH)가 있으며, 이는 저산소증 유도 인자 HIF1의 하위 단위 α 분해가 시작되는 동안 배열됩니다. 그리고 HIF2. HIF는 종양에서 자주 발생하는 혐기성 상태에 대한 세포 적응에 참여합니다[ 29 ]. 종양의 미세환경은 건강한 조직에서 관찰되는 것과는 다릅니다. 종양 세포는 매우 빠르고 자주 분열하는 능력을 가지고 있습니다. 따라서 종양 질량을 증가시키면 혈관으로부터 분리가 발생합니다. 암 발병에서는 혈관신생이 흔하지만, 새로 형성된 혈관은 구조와 기능 면에서 건강한 혈관과 다릅니다[ 30 ]. 종합하면, 상응하는 건강한 조직에서 관찰되는 압력과 비교하여 종양 덩어리의 산소 분압이 감소합니다[ 31 , 32 ]. 종양의 저산소 상태는 종양의 침습성과 전이 능력을 증가시킬 수 있습니다 [ 33 ]. HIF는 구성적으로 발현되는 두 개의 하위 단위인 α와 β로 구성됩니다. 정상 산소 조건에서 하위 단위 α는 HPH와 FIH에 의해 수산화됩니다. 다단계 번역 후 과정 후에 하위 단위 α는 프로테아좀에 의해 분해됩니다 [ 29 ]. 그러나 저산소 상태에서는 소단위체 α가 안정화된 후 β 소단위체와 결합하여 결국 특정 유전자의 전사를 촉진한다. HIF1-α와 HIF2-α는 전사 조절을 통해 서로 다릅니다. HIF1-α는 주로 세포 대사 변화와 관련된 유전자의 조절을 담당하고, HIF2-α는 세포 신호 전달 및 세포외 기질과 관련된 유전자의 조절을 담당합니다. 리모델링 요인 [ 34 , 35 , 36 ]. 더욱이, 두 요인 모두 저산소증 동안 서로 다른 발현을 나타냅니다. 즉, 급성 저산소 상태에서는 HIF1-α가 높게 발현되는 반면, 장기간 저산소증은 HIF2-α 축적을 초래합니다[ 37 ]. 하위 단위 α 안정화가 HIF 발현에 중요하다는 점을 고려하면 HPH와 FIH는 혐기성 상태에서 세포 적응에 기여하는 주요 요인입니다. 따라서 이러한 효소의 조절 장애 자체가 암 발병의 원인이 될 수 있습니다.
3. 비타민 C 수송체: 인체 내 기능 및 분포
1970년대 후반 Cameron et al. 비타민 C(구강 10g, 정맥 10g)를 섭취한 암 환자의 상당한 회복을 특징으로 하는 연구를 발표했습니다[ 38 ]. 몇 년 후, 두 개의 독립적인 무작위 대조 연구에 따르면 암 환자가 매일 10g의 아스코르베이트를 경구 섭취하면 위약으로 치료받은 환자와 유의한 차이가 없는 것으로 나타났습니다[ 39 , 40 ]. 그러나 이러한 모든 연구에는 몇 가지 심각한 한계가 있습니다. 위에서 언급한 연구에서 주요 누락은 비타민 C의 투여 경로와 인체 내 비타민의 약동학입니다. 아스코르브산 섭취량과 혈장 및 조직 내 농도, 생체 이용률 및 요로 배설 사이의 관계에 대한 예비 종합 연구는 Levine 등이 수행했습니다. [ 41 ]. 저자들은 7명의 건강한 지원자의 결과를 바탕으로 비타민C의 일일 권장 섭취량이 200mg/일이지만 아스코르브산의 소변 배설을 유도하는 용량은 더 낮은(100mg/일) 것으로 판단했습니다. 더욱이, 500mg/일보다 높은 용량은 효과가 없어 거의 소변으로 배설되는 것으로 나타났습니다. 또한, 매일 투여되는 100mg의 비타민 C는 대략 60μM의 혈장 아스코르브산 농도를 담당했으며, 더 중요한 것은 경구 섭취량이 많을수록 혈장 농도가 최대 75-90μM까지 생성된다는 것입니다[ 41 ]. 이 발견은 아스코르브산의 경구 투여와 혈장 아스코르베이트 농도의 높은 포화도 사이의 명확한 관계를 강조합니다. 이러한 결과는 신장 재흡수 및 배설에 의한 아스코르브산 혈장 농도의 엄격한 제어를 더욱 뒷받침합니다[ 42 , 43 ]. 또한, 앞선 연구들은 비타민 C 투여 경로가 혈장 농도에 중요한 요소라는 것을 명확하게 보여주었습니다. 아스코르브산의 정맥 내 섭취가 경구 투여량의 상한 수준에 비해 혈장 농도를 30~60배 증가시키는 데 기여할 수 있다는 것이 철저히 입증되었습니다[ 41 , 42 , 43 ].
비타민 C는 흡수에서 제거까지 복잡한 약동학 범위를 나타내기 때문에 능동 또는 수동 수송 메커니즘을 통해 비타민 C를 조절하는 특수 수송체에 의해 대사가 수행되어야 합니다.
아스코르빈산 투여 후에는 소화관에서 흡수되고 조직에 축적되며 신장에서 재흡수 및 배설됩니다. 이는 쥐에게서 처음으로 복제된 나트륨 의존성 비타민 C 수송체 SVCT1 및 SVCT2를 통한 세포막을 통한 능동 수송을 통해 달성될 수 있습니다[ 44 ]. SVCT는 아스코르브산의 유입과 세포 내 나트륨 유입을 결합하여 아스코르브산을 구배에 대해 적극적으로 수송할 수 있으며, 이에 따라 Na/K-ATPase에 의해 제공되는 원형질막 전체에 나트륨 구배를 유지합니다[ 44 , 45 , 46 ]. 그러나 SVCT2는 SVCT1과 달리 생물학적 효율성을 완전히 유지하기 위해 특정 이온(Ca 2+ /Mg 2+ )이 필요합니다[ 46 ]. SVCT1과 SVCT2는 모두 변형되지 않은 형태의 아스코르브산에 높은 친화력을 보이는 반면, 다른 형태의 비타민 C는 기질로 사용될 수 없습니다[ 44 , 47 ]. 각 수송체는 SLC23A1 또는 SLC23A2 라는 서로 다른 유전자의 산물입니다 . SLC23A1은 염색체 5(유전자좌 5q31.2-31.3)에 위치하는 반면, SLC23A2는 염색체 20(유전자좌 20p12.2-12.3)에 매핑됩니다. 두 효소 모두 66%의 아미노산 서열 동일성을 나타내지만 독특한 조직 분포를 특징으로 합니다[ 48 , 49 ]. 흥미롭게도 Bürzle et al. 기능이 불분명한 고아 수송체인 세 번째 수송체인 SVTC3을 확인했습니다. 그러나 이 수송체는 SVCT1 및 SVCT2와 대략 30%의 서열 동일성을 나타냅니다[ 50 ]. SVCT3의 기능을 확립하려면 추가 작업이 필요합니다. 지금까지 SVCT1과 SVCT2에 대한 많은 연구가 발표되었습니다. SVCT1은 소장, 간, 췌장, 신장, 생식 기관, 폐 및 피부의 상피에서 고도로 발현됩니다[ 44 , 51 ]. SVCT1과 SVCT2는 모두 장에서 발견됩니다. 그러나 SVCT1의 발현은 SVCT2의 발현보다 크다[ 44 ]. SVCT1의 가장 중요한 위치는 아스코르빈산의 신장 재흡수에 관여하는 신장 조직의 근위세뇨관의 브러시 경계막입니다. 결과적으로, SVCT1은 주로 인체의 비타민 C 수준을 유지하는 데 관여합니다[ 52 , 53 ]. 따라서 생쥐에서 Slc23a1 유전자 의 녹아웃은 거의 완전한 비타민 C 소변 배설을 제공하여 아스코르베이트 조직 공급의 약 70%를 손실합니다 .]. 결과적으로, 영장류에서 SVCT1 발현의 상실은 스스로 아스코르브산을 합성할 수 없기 때문에 더 심각한 결과를 초래할 수 있습니다. 더욱이, 아스코르브산 수송 친화도 및 용량에 관한 연구는 신장의 아스코르브산 재흡수에서 SVCT1의 핵심 역할을 강조합니다. SVCT1의 아스코르브산에 대한 친화도는 낮지만 SVCT1은 이 화합물을 고용량으로 수송할 수 있습니다[ 44 , 47 ]. 대조적으로, 다른 비타민 C 운반체인 SVCT2는 높은 친화력으로 비타민 C를 운반하지만 상대적으로 용량은 낮습니다[ 47 ]. SVCT2는 인체의 거의 모든 세포, 특히 눈, 부신, 뇌와 같이 비타민 C를 축적하는 세포에서 발현됩니다[ 44 , 51 ]. Sotiriouet al. 저자는 쥐 모델에서 Slc23a2 유전자의 유전적 녹아웃을 적용한 연구를 수행했습니다. SVCT2 유사체가 결여된 생쥐의 출생 전 아스코르브산 보충은 아무런 효과가 없었으며 생쥐는 뇌출혈로 인해 출생 후 몇 분 이내에 사망했습니다[ 54 ]. 따라서 SCVT2는 뇌 발달에 필수적이라고 여겨진다. 이 연구에 맞춰 Parker et al. 뇌 미세혈관에서 발견되는 혈관주위세포에는 SVCT2 수송체가 풍부하여 미세혈관이 아스코르베이트를 수집할 수 있다는 사실이 밝혀졌습니다[ 55 ].
비타민 C는 pH 변화에 따라 쉽게 산화되어 DHA로 변환되기 때문에 이러한 변화는 비타민 C 수송을 방해하지 않습니다. DHA 수송은 나트륨과 무관한 과정인 포도당 수송체(GLUT)에 의한 촉진 확산을 통해 매개될 수 있습니다. 더욱이, 환원된 형태의 비타민 C(AA)는 GLUT 수송체를 통해 전달되지 않습니다[ 56 , 57 , 58 ]. 확산 후 DHA는 글루타티온과 NADPH의 동시 산화와 함께 AA 형태로 빠르게 환원됩니다. 이는 문헌에서 아스코르베이트 재활용이라고 합니다[ 60 ]. 문헌 검토에서 언급한 바와 같이, GLUT 계열은 인체 대부분의 조직에서 확인된 14개 구성원으로 구성됩니다. 주로, 이들 구성원은 세포외 공간과 세포 사이의 포도당 수송을 담당합니다[ 61 ]. 그럼에도 불구하고, 이전 연구에서는 GLUT 계열의 구성원이 GLUT1, GLUT3 및 GLUT4를 통해 DHA를 운반할 수도 있지만[ 56 , 57 ] 이러한 운반체 중 어느 것도 비타민 C가 흡수되는 장세포에서 발현되지 않는 것으로 나타났습니다[ 58 ]. GLUT2와 GLUT8은 장에서 발현되며, 이 두 수송체는 DHA 전달에 관여하는 것으로 추정됩니다[ 58 ]. 그러나 Corpe 등에 따르면 GLUT에 의한 DHA 수송은 식이 요인에 의해 방해를 받을 수 있으며, 이는 결국 비타민 C의 생체 이용률을 감소시킵니다[ 58 ]. 게다가 몇몇 GLUT는 DHA보다 포도당에 대한 친화력이 상당히 약합니다. 이러한 관찰에 따라 여러 세포 배양 연구에서는 DHA 수송이 비타민 C 축적의 대체 경로이거나 심지어 주요 경로임을 시사합니다[ 62 , 63 ]. 그러나 이후 쥐 모델에 대한 연구에서는 정상적으로 작동하는 GLUT에도 불구하고 쥐의 SVCT2 녹아웃으로 인해 쥐가 사망하는 것으로 나타났습니다[ 54 ]. 중요한 질문은 DHA 수송의 동일한 경로가 인간과 생쥐(또는 다른 동물) 모델에 존재하는지 여부입니다. 우리가 아는 한, GLUT 수송체는 인간과 쥐의 적혈구에서 다양하며[ 64 ], 인간과 쥐는 장에서 서로 다른 GLUT 발현을 보입니다[ 65 ].
한편, 암세포에서 GLUT가 제공하는 비타민 C 수송의 핵심 역할에 관한 여러 연구가 있습니다[ 66 , 67 ]. Pena 등의 최근 논문. 세포외 공간에서 암세포로 전달된 비타민 C의 대부분이 DHA의 형태를 취한다고 제안했습니다[ 66 ]. 저자들은 암세포가 SVCT2의 비정상적인 형태를 발현하더라도 GLUT 수송체를 사용하고 세포 내부에서 DHA를 AA로 전환함으로써 비타민 C를 획득할 수 있다고 보고했습니다[ 66 ]. 이 현상을 방관자 효과라고 하며 이전에 자세히 설명되었습니다[ 63 ].
4. 비타민C가 암세포에 미치는 영향
비타민 C의 다발성 기능으로 인해 이 화합물을 잠재적인 항암제로 사용한다는 아이디어는 새로운 것이 아닙니다. 그러나 지난 10년 동안 암 치료에 대한 새로운 접근법이 점점 더 급속하게 발전했습니다. 암 환자는 건강한 환자에 비해 혈장 내 비타민 C 수치가 현저히 낮다는 데 일반적으로 동의합니다 [ 8 , 68 , 69 ]. 더욱이, 이전 연구에서는 아스코르베이트 결핍이 암세포의 침습성을 향상시킬 수 있다는 것이 결정적으로 입증되었습니다[ 70 , 71 ]. 비타민 C 고갈에 대한 그럴듯한 설명 중 하나는 발암 과정에서 세포의 산화 스트레스와 활성 산소종(ROS) 형성입니다. 암세포는 세포 소기관(주로 미토콘드리아)의 기능 장애로 인해 다양한 대사 과정을 보인다는 것이 널리 알려져 있습니다. 이는 결국 과도한 ROS 생성으로 이어지며, 이어서 만성 염증이 발생합니다[ 72 , 73 ]. 비타민C는 항산화 능력으로 인해 라디칼 제거제 역할을 하며 ROS 제거에 중추적인 역할을 하기 때문에 활성산소가 과도하게 생성되면 비타민C 수치가 결국 감소할 수 있습니다[ 74 ]. 따라서 비타민C는 암 치료에 큰 가치가 있을 수 있다고 제안되었습니다. 이 가설에 따라, 약리학적 농도에서도 비타민 C가 시험관 내 및 생체 내에서 암 세포를 파괴하는 능력에 대해 상당한 양의 문헌이 발표되었습니다[ 7 , 75 , 76 ]. 더욱이, 아스코르베이트는 암 성장을 억제하는 능력을 가지고 있는 것으로 나타났습니다[ 77 ]. 비타민C가 항암 작용을 발휘할 수 있는 방법에는 여러 가지가 있습니다. 그 중 하나는 비타민 C의 산화촉진 능력으로, 주로 고용량에서 나타나며 정맥 투여를 통해서만 접근할 수 있습니다. Chen et al.이 제공한 여러 연구. 비타민C가 암세포에서 아스코르베이트 라디칼 생성의 중간체로 과산화수소(H2O2 ) 를 생성 할 수 있다는 사실이 밝혀졌습니다[ 7 , 75 , 77 ]. H 2 O 2 는 ROS 중 하나로 세포의 산화환원 상태를 유지하는 데 핵심적인 역할을 하며, 암세포의 대사를 방해하는 데 영향을 미칠 수 있습니다[ 78 ]. Uetaki 등에 따르면, 비타민 C의 항암 작용의 주요 목표는 NAD 감소를 통한 해당작용의 억제입니다[ 78 ]. 흥미롭게 도 비타민C 세포독성은 정상세포는 생략하고 종양세포에서만 관찰된다.]. 이러한 차이는 암세포의 ATP 생성 방식이 변경된 결과일 수 있습니다. 즉, 산화적 증식 대신 이러한 세포는 호기성 상태에서도 우선적으로 해당작용을 받습니다. 이 과정은 일반적으로 Warburg 효과로 알려져 있습니다[ 79 ]. 따라서 비타민 C는 이 과정에서 표적이 되며 주로 종양 세포의 에너지 생산을 담당합니다. 또한, 이전에 입증된 바와 같이 일부 암 관련 돌연변이는 실제로 Warburg 효과와 연관되어 있습니다[ 80 , 81 ]. 대장암에서 발생하는 KRAS 또는 BRAF 돌연변이도 포도당 흡수 및 GLUT1 과발현에 기여할 수 있습니다 [ 82 ]. 언급한 바와 같이, GLUT1은 DHA를 운반하는데, 이는 세포로 전달된 후 직접 아스코르브산으로 환원됩니다[ 59 ]. KRAS 및 BRAF 돌연변이 세포에 있는 다량의 GLUT1은 고용량 비타민 C의 표적이 될 수 있으며, 이는 궁극적으로 ROS 생성 및 암세포 사멸로 이어질 수 있습니다[ 81 ].
그러나 발암 과정에서 비정상적인 세포 기능은 산소 이용 가능성을 감소시키는 경향이 있으며[ 83 ], 암세포의 저산소 상태는 비타민 C의 세포 독성 효과를 억제할 수 있습니다[ 84 ]. 따라서, 여러 효소의 촉매 중심에서 발견될 수 있는 철 이온과 반응하는 비타민 C의 잠재력에 기초하여 암세포에 대한 비타민 C의 선택적 공격에 대한 두 번째 설명이 있습니다[ 3 ]. Ngo 등이 제안한 가설에 따르면, 특정 암 미세환경에는 Fe 2+ 이온이 풍부하며 , 이는 비타민 C와의 반응을 통해 H 2 O 2 및 OH를 생성할 수 있습니다[ 85 ]. 더욱이, 암세포 내부의 Fe 2+ 강화는 비타민 C 자가산화의 중간체인 세포외 공간으로부터 H 2 O 2 의 확산을 자극할 수 있습니다 [ 85 ]. 두 경우 모두 과도한 양의 H 2 O 2 는 암세포에 세포 독성을 일으킬 수 있습니다.•
점점 더 많은 연구에서 메틸화와 탈메틸화 사이의 균형이 여러 유형의 암에서 교란된다는 사실이 입증되었습니다[ 23 , 86 , 87 , 88 ]. 5mC 변화는 종양의 5hmC 감소를 수반하는 것으로 밝혀졌습니다[ 23 , 24 ]. 이러한 변화는 발암을 유발할 수 있는 종양 유전자 및 종양 억제 유전자를 포함하여 인체의 주요 유전자의 전사에 영향을 미치는 것으로 입증되었습니다[ 89 ]. 더욱이 최근에는 비타민 C 수준이 5-hmC와 상관관계가 있다는 것이 밝혀졌으며[ 90 ], 5-hmC가 잠재적으로 유전자 발현 조절에 관여하기 때문에[ 25 ], 아스코르베이트도 이 과정에 관여할 수 있습니다. 아스코르베이트는 2-OGGD 계열의 구성원인 TET 단백질의 보조 인자입니다. 여러 in vitro[ 16 , 91 , 92 , 93 ] 및 in vivo[ 94 ] 연구에서 아스코르베이트는 5-hmC를 증가시키는 능력이 있음이 입증되었습니다. 시험관 내 비타민 C 제거는 5mC 수준의 병행 증가와 함께 5-hmC 수준의 현저한 감소와 상관관계가 있다는 것도 주목할 만합니다[ 91 ]. 더욱이, TET2 돌연변이는 혈액학적 악성종양에서 종종 발생하는데, 약 10%는 급성 골수성 백혈병, 30%는 골수이형성증후군, 50%는 만성 골수단구성 백혈병에서 발생합니다[ 95 ]. 특히 TET2 돌연변이의 경우 비타민 C를 적용하면 TET2 결핍을 회복하고 DNA 탈메틸화를 촉진하는 능력이 있습니다 . 백혈병 세포에서 TET2 효소와 아스코르베이트 요법 사이의 관계는 Zhao 등의 연구에서도 발견되었습니다. [ 97 ], 그는 비타민 C 투여가 TET2 활성을 증가시킨다는 것을 발견했습니다. 그러나 TET2 발현 측면에서는 유사한 효과가 검출되지 않았다[ 97 ]. 암 치료에서 비타민 C는 종양 성장 및 전이 억제에 다른 유익한 효과가 있습니다(아래에서 논의됨)[ 92 , 98 , 99 , 100 ]. 이는 DNA 메틸화의 변화로 인한 유전자의 전사 및 발현 변화와 관련될 수 있습니다 . 위에서 언급한 바와 같이, 비타민 C에 의존하는 후생유전체를 조절하는 다른 효소는 염색질 변화와 연결된 JHDM입니다[ 18 ]. 여러 연구에서 비타민 C 가 조혈 및 체세포 재프로그래밍 중에 발생하는 JHDM 의존성 염색질 탈메틸화에 기여하는 중요한 물질 임을 확인 했습니다 .]. DNA 메틸화 변화가 다양한 후성유전 과정 중에서 가장 널리 퍼져 있다는 점을 고려하면, 비타민 C는 유전자 발현 조절에 큰 가치를 가질 가능성이 높습니다.
5. 보조 암 치료에서의 비타민 C
비타민 C는 지난 수십 년 동안 암 환자를 위한 보완 또는 대체 치료법으로 자주 처방되었습니다. 정맥 내 아스코르빈산 투여가 안전하다는 보고에 이어[ 105 ], 다양한 암에서 아스코르빈산 요법을 시행하는 것에 관한 문헌의 양이 증가하고 있습니다. 그러나 질문해야 할 한 가지 질문은 비타민 C가 기존 화학 요법이나 방사선 요법에 영향을 미치는지 여부입니다. 비타민C는 화학요법이나 방사선요법의 부작용을 예방하는데 효과적인 것으로 보인다[ 106 , 107 ]. 그러나 방사선 치료 중에 생성된 ROS는 비타민C에 의해 제거될 수 있으며, 이는 방사선 요법의 치료 효과를 감소시킬 수 있습니다. 마찬가지로, 약리학적 작용이 ROS 생성에 기초한 화학요법제 역시 비타민 C 보충 하에서는 비효율적일 수 있습니다 [ 108 ]. 따라서 이 분야에 대해서는 여전히 더 많은 연구가 필요하다.
5.1. 혈액학적 악성종양
백혈병 세포에 대한 시험관 내 연구에서는 아스코르브산이 암세포의 성장을 조절하는 데 중요한 역할을 한다는 사실이 입증되었습니다[ 109 ]. 더욱이, 아스코르브산의 약리학적 농도조차도 다발성 골수종 환자의 혈액 샘플에서 특히 원발성 암세포를 죽이는 데 충분합니다[ 110 ]. 최근 시험관 내 연구에서는 비타민 C가 SMAD1 발현 유도를 통해 림프종 세포주의 화학 감수성 증가에 기여할 수 있다고 제안했는데, 이는 미만성 거대 B 세포 림프종에서 메틸화에 의해 자주 침묵됩니다 [ 111 ]. 더욱이, 림프종의 단계는 비타민 C 수치와 반비례합니다[ 111 ]. 아스코르빈산은 AML 환자의 저메틸화제에 대한 보조 요법으로도 성공적으로 사용되었습니다[ 97 ]. 또한, 최근 임상 보고서는 TET2 돌연변이가 있는 AML의 경우 아스코르베이트 정맥 투여의 유익한 역할을 뒷받침합니다 [ 112 ]. 더욱이, 재발이 있는 AML에서 비타민 C를 비경구적으로 사용하면 혈액 세포 수와 삶의 질이 크게 향상됩니다[ 113 ].
5.2. 유방암
혈액학적 악성종양과 유사하게, 비타민 C는 더 심각한 유방암의 경우 감소합니다[ 114 ]. 더욱이, 유방 종양의 비타민 C 수치 감소는 HIF-1 경로 활성의 증가 및 괴사의 진행 단계와 관련이 있습니다[ 114 ]. 더욱이, 최근 연구에 따르면 아스코르브산은 유방암 세포주에서 세포사멸을 유도할 수 있는 것으로 나타났습니다. 저자에 따르면, 비타민 C는 TRAIL의 상향 조절과 관련이 있으며, 이는 세포사멸 유도제인 것으로 입증되었습니다[ 115 ]. 아스코르브산은 또한 상피-중간엽 전이를 억제하여 유방암 세포주의 침입과 이동을 억제하는 데 기여합니다[ 116 ]. 흥미롭게도 삼중 음성 유방암 세포주에 대한 시험관 내 연구에서는 경구 섭취로 얻을 수 있는 비타민 C의 농도가 전이 활동을 억제하기에 충분하다는 사실이 입증되었습니다[ 100 ]. 더욱이, 생체 내 연구에서는 아스코르브산의 식이 보충제가 유방암 환자의 사망률을 감소시킬 수 있음을 보여주었습니다[ 117 ]. 놀랍게도 폐경기 여성의 아스코르빈산 섭취는 실제로 유방암 발병 위험을 증가시킬 수 있습니다 [ 118 ].
5.3. 흑색종
시험관 내 연구와 쥐 모델에서는 비타민 C가 흑색종 세포의 침입과 성장을 억제하는 것으로 나타났습니다[ 70 , 71 , 92 ]. Chen 등에 따르면, 아스코르브산은 Bax/Bcl-2 경로를 자극하여 흑색종 세포의 세포사멸을 촉진하는데, 이는 카스파제의 활성화에 이어 단백질 분해와 세포 사멸을 유도합니다[ 119 ]. 또한 Yang et al. 아스코르브산이 용량 의존 방식으로 흑색종 세포에서 세포 독성을 유도한다고 제안했습니다 [ 120 ]. 높은 농도의 비타민 C만으로도 세포 사멸을 유도하는 데 충분하지만, 낮은 농도의 비타민 C에서는 실제로 침습성과 종양 성장을 촉진할 수 있습니다 [ 120 ]. 비타민 C는 또한 정상 산소 상태에서 HIF1-α 단백질의 조절에 중요한 역할을 합니다. 그러나 암세포에서 HIF1-α의 발현은 광범위하므로 흑색종 세포 운동성 및 침입과 관련된 특정 단백질의 발현에 도움이 될 수 있습니다[ 121 ]. 또한, 시험관 내 연구에서는 흑색종 세포에서 유도된 멜라닌 생성 과정이 실제로 HIF1-α 발현 증가의 원인이 될 수 있음을 보여주었습니다[ 122 ]. 흑색종 세포주에서 아스코르브산 보충은 HIF1-α 활성 및 축적 조절에 기여합니다 [ 123 , 124 ]. 흥미롭게도 DHA 보충에서는 비슷한 효과가 나타나지 않았습니다. 따라서 HIF1-α 안정성의 아스코르빈산 조절은 SVCT 활성에 의존하는 것이 가능한 것으로 보입니다. 더욱이, HIF1-α가 흑색종 및 교모세포종 세포주에서 TET2 단백질과 상호작용할 수 있다는 것이 제안되었습니다[ 123 ]. TET2 녹다운을 통해 흑색종 세포주에 아스코르브산을 보충하면 5-hmC가 증가했습니다. 또한, HIF1-α 녹다운은 흑색종과 교모세포종 세포에서 TET2 발현을 향상시키는 데 기여했으며[ 123 ], 이는 악성 세포에서 이 두 단백질 사이의 발현 조절에 대한 그럴듯한 조절에 새로운 빛을 비췄습니다.
5.4. 신경교종과 교모세포종
아스코르브산나트륨의 밀리몰 용량은 또한 시험관 내 및 생체 내 모델 모두에서 교모세포종 세포 침입 및 생존 능력의 억제에 관련 영향을 미치는 것으로 여겨집니다[ 125 ]. 그러나 저자에 따르면, 아스코르브산 나트륨에 의해 유발되는 아우토슈치지스(autoschizis)라고 불리는 특정 형태의 세포 사멸은 비타민 C를 보조 암 치료법으로 사용하기 전에 추가 검사가 필요합니다[ 125 ]. 그럼에도 불구하고 Zhou et al. 비타민 C 섭취가 신경교종 발병 가능성을 줄이는 데 도움이 될 수 있음을 나타냅니다 [ 126 ]. 또한 여러 연구에 따르면 신경교종 환자의 경우 정맥 내 보충이 보조 종양 치료법으로 성공적으로 작용할 수 있으며 생존율을 크게 높일 수 있을 뿐만 아니라 종양을 감소시키고 안정화시킬 수 있습니다[ 127 , 128 ].
5.5. 전립선암
앞서 언급한 시험관 내 연구와 유사하게, 전립선암 세포주에 대한 비타민 C의 효과는 해당 세포주의 증식과 이동을 억제합니다[ 125 ]. 그러나 생체 내 연구의 실험 데이터는 다소 논란의 여지가 있으며 전립선 종양에 대한 아스코르빈산의 효과에 대한 일반적인 합의는 없습니다. 전립선암에 걸린 쥐에게 비타민C를 비경구 투여한 결과 유망한 결과가 나타났습니다. 아스코르브산은 종양 억제 및 전이 억제에 기여했습니다[ 98 ]. 18개 이상의 전립선암 연구로 구성된 메타 분석에서도 비타민 C와 전립선암 발병률 감소 사이의 연관성을 나타내는 유리한 결과가 나타났습니다[ 129 ]. 흥미롭게도 전립선암 및 환경 연구(The Prostate Cancer and Environment Study)에 따르면 식이 투여를 통한 아스코르브산은 전립선암의 위험을 감소시키지 않거나 진단 시 공격성을 낮추지 않습니다[ 130 ]. 비타민 C 보충이 전립선암 발생에 기여하지 않았다는 것을 지적한 Wang 등의 시험 후 연구에서도 유사한 결과가 얻어졌습니다[ 131 ].
6. 암에서 SVCT 기능 손상
6.1. SVCT의 다형성
혈장과 조직의 비타민 C 농도는 암 발생의 주요 원인 중 하나로 확인되었습니다. 위에서 언급한 바와 같이, 암 환자는 혈장 내 비타민 C 수치가 낮은 경우가 많습니다 [ 8 , 68 , 69 ]. ROS 생성과 암세포의 산화환원 상태 변화와는 별개로, 이 현상은 비타민 C 운반체 SVCT1과 SVCT2의 단일 염기 다형성(SNP)과 연관될 수 있다고 제안되었습니다. SLC23A1 및 SLC23A2 의 코딩 영역에 있는 SNP는 혈장 내 비타민 C 수준 및 이의 수송 억제와 관련이 있습니다[ 132 , 133 ]. Timpson et al.의 15000명의 참가자를 대상으로 한 코호트 연구. SLC23A1 rs33972313이 비타민 C 순환 농도 감소에 관여하며 4 µmol 이상 감소한다는 것이 결론적으로 입증되었습니다 [ 132 ]. Corpe 등의 쥐 연구에 따르면, SLC23A1 rs33972313은 세포 내 아스코르베이트 축적을 40~50% 감소시키는 것과 관련이 있습니다[ 52 ]. 또한, EPIC(European Prospective Investigation into Cancer and Nutrition) 코호트 연구에서는 SVCT1 및 SVCT2 SNP 모두 비타민 C 혈장 농도와 관련이 있음이 밝혀졌습니다[ 133 ]. 이 연구에서는 두 개의 SLC23A1 SNP인 rs11950646과 rs33972313이 각각 10~13% 및 24%의 비타민 C 감소에 관여하는 것으로 확인되었습니다. 흥미롭게도 두 개의 SLC23A2 SNP인 rs6053005 및 rs6133175는 둘 다 아스코르브산의 24% 증가와 관련이 있는 것으로 밝혀졌습니다[ 133 ]. 이러한 불일치는 비타민 C 수송체의 역할과 위치 지정 유형이 다르기 때문에 발생할 수 있습니다. 이 주제에 대해서는 추가 연구가 필요하지만 SVCT1 및 SVCT2 SNP는 아스코르브산 수준 예측 인자 역할을 할 수 있습니다.
이 과정은 아직 연구 중이지만 이전 연구에서는 SVCT SNP가 여러 암에 관여한다고 보고했습니다. SVCT1은 비타민 C 흡수 및 재흡수를 담당하므로 위암에서 SLC23A1 SNP를 찾는 것이 가능합니다. 놀랍게도 SVCT1 유전적 다형성 중 어느 것도 위암 위험과 관련이 없습니다[ 133 , 134 ]. 그러나 두 번째 비타민 C 운반체 SVCT2: SLC23A2 ( SLC23A2 rs6116568 및 SLC23A2 rs12479919)의 다형성은 위암 발병과 상관관계가 있었습니다[ 133 , 134 ]. 위액과 점막의 비타민 C 농도는 혈장에서 관찰된 것보다 상당히 높습니다. 이는 위 기능에서 비타민 C의 중요한 역할을 강조합니다. 그러나 이전 연구에서는 쥐 위샘에 SVCT1 대신 SVCT2가 풍부한 것으로 나타났습니다[ 44 ]. 따라서 SVCT2만으로도 비타민 C 흡수에 중요한 역할을 할 수 있습니다.
암에 SVCT1의 유전적 다형성이 관여하는 것은 여포성 림프종에서 발견되었습니다. 대규모 인구 기반 사례 대조 연구에서는 SLC23A1 rs6596472 및 SLC23A1 rs11950646이 여포성 림프종의 위험을 최대 80%까지 증가시킬 수 있는 것으로 나타났습니다[ 136 ]. 여포성 림프종의 위험 증가는 SVCT2( SLC23A2 rs1776948) 의 유전적 변이와도 관련이 있었습니다 . 동일한 변종과 다른 두 가지( SLC23A2 rs6133175 및 SLC23A2 rs1715364)도 만성 림프구성 백혈병(CLL)에서 확인되었습니다[ 136 ]. 400개 이상의 CLL 사례를 대상으로 한 연구에서는 동일한 두 SVCT2 다형성( SLC23A2 rs6133175 및 SLC23A2 rs1776948)과 CLL 발달 사이의 유의한 상관관계가 발견되었습니다[ 137 ]. 더욱이 SLC23A2 의 이러한 유전적 변이체는 비타민 C의 주요 공급원인 과일 및 채소 섭취에 의해 조절될 수 없습니다. 그러나 CLL 환자는 건강한 대상보다 과일 섭취량이 더 많았습니다[ 137 ]. 식이 비타민 C 섭취도 진행성 대장 선종의 위험과 관련이 없는 것으로 밝혀졌습니다 [ 138 ]. 그러나 이 암의 발병률은 SVCT2, SLC23A2 rs4987219 및 SLC23A2 rs1110277의 두 가지 유전적 변이와 상관관계가 있었습니다[ 138 ]. 유전자 변이체 SLC23A2 rs4987219는 또한 인간 유두종 바이러스 16(HPV16) 관련 두경부암의 변형 가능성이 있는 것으로 밝혀졌습니다[ 139 ]. 이 연구에 따르면, HPV16 감염에 따른 두경부암의 소인은 비타민 C 대사와 밀접한 관련이 있는 것으로 나타났습니다. SVCT 수송체의 유전적 변이는 HPV16에 대한 뚜렷한 노출을 갖는 것으로 제안되었습니다[ 139 ]. SLC23A1 및 SLC23A2 유전자에서 발견되는 SNP가 전사 조절에 영향을 미칠 수 있다는 점을 배제할 수 없습니다 . SVCT 다형성의 모든 알려진 효과는 다음과 같이 수집됩니다.1 번 테이블.
6.2. SVCT의 변형된 발현
SVCT1의 위치는 대부분 상피 조직으로 제한됩니다. 따라서 SVCT1은 주로 비타민 C 항상성과 전신 순환을 담당합니다[ 44 , 51 ]. SLC23A1 의 손실이 생쥐의 심각한 비타민 C 결핍에 기여한다는 점을 고려하면[ 52 ] SVCT1의 변화는 인간에서 훨씬 더 심각할 수 있는 것으로 보입니다. 현재까지 인간의 SVCT1 손실에 대한 연구는 없습니다. 반면, SVCT2는 대부분의 대사 활성 조직에 위치하며 아마도 비타민 C 축적을 조절합니다[ 44 , 51 ]. 따라서 SVCT2의 변형이 발암에 관여할 가능성이 있는 것 같습니다. 따라서 여러 연구에서 SVCT2 발현을 분석했습니다. SVCT2 발현은 여러 종양 샘플에서 검출되었으며, 막보다는 세포내 면역반응의 비율이 훨씬 더 높았습니다[ 67 ]. 더욱이, 유방암에 대한 연구에서는 유방 종양에서 SVCT2의 차등적 발현이 나타났으며, 이는 호르몬 비의존성 유방암에서 가장 높은 수준이었습니다. 그러나 정상적인 유방 상피 샘플에서는 SVCT2 발현이 나타나지 않았습니다. 흥미롭게도 유방 종양 샘플에서 SVCT1의 발현은 검출되지 않았습니다[ 66 ]. 유방암 세포주에 대한 추가 조사에서는 이들 세포주가 SVCT 수송체를 통해 아스코르브산 형태의 비타민 C를 섭취할 수 없으며 GLUT 수송체를 사용하여 DHA로서 아스코르브산 형태로만 섭취할 수 있다는 사실이 밝혀졌습니다. 이 관찰은 세포막의 SVCT2 결핍을 나타냅니다. 그러나 이 수송체의 발현은 미토콘드리아에서 확인되었으며, 이는 아마도 낮은 친화력의 비타민 C 수송을 담당하는 것으로 추정됩니다[ 66 ]. Hong 등의 연구에 따르면 SVCT2는 아스코르베이트 유발 암세포 사멸에 중요합니다[ 140 ]. SVCT2를 통해 암세포로의 아스코르베이트 수송은 향상된 세포내 ROS 생성과 연관되어 있으며, 이는 결국 유방암 세포 종결로 이어집니다. 더욱이, 이전에 SVCT2 발현이 높았던 유방암 세포에서 SVCT2 녹다운은 아스코르브산 치료에 대한 저항성을 초래했습니다[ 140 ]. SVCT2 발현과 아스코르브산 처리 사이의 연관성은 대장암 세포주에서도 평가되었습니다 .]. 이전 연구와 유사하게 아스코르브산의 세포독성은 SVCT2의 발현에 비례했습니다. 더욱이, 아스코르브산 처리에 대한 세포 반응은 SVCT2 발현에 의존적이었습니다. SVCT2 발현 수준이 낮은 암세포는 고용량의 아스코르브산에서 항암 효과를 나타내고 이 화합물의 저용량에서 증식 효과를 나타냈습니다. 대조적으로, SVCT2 발현이 높은 암세포는 모든 아스코르브산 농도에서 항암 효과를 나타냈습니다. 이러한 불일치에 대한 가능한 설명은 SVCT2 발현이 낮은 대장암 세포에서 낮은 아스코르브산 농도에서 ROS 생성이 불충분하다는 것입니다 [ 141 ]. SVCT2 발현에 의존하는 아스코르브산에 의해 유도된 강화된 세포 독성은 간세포암[ 142 ] 및 담관암종[ 143 ] 에서도 조사되었습니다 . 더욱이 KRAS 돌연변이가 있는 대장암은 이들 암 치료에 사용되는 주요 약물인 cetuximab에 내성을 보이는 경우가 많습니다[ 144 ]. KRAS 돌연변이가 있는 결장암 세포에 대한 시험관 내 연구에서는 비타민 C가 세툭시맙과 협력하여 SVCT2 발현에 따라 세포 사멸을 유도할 수 있음을 보여주었습니다[ 145 ]. 저자에 따르면, 세툭시맙과 결합된 아스코르브산은 KRAS 돌연변이가 있는 결장암에서 교란되는 MAPK/ERK 신호 전달 경로에 영향을 미칠 수 있습니다. 그러나 아스코르브산과 세툭시맙 노출 후 MAPK/ERK 신호 전달의 특정 변화는 SVCT2 발현이 있는 대장암 세포에서만 관찰되었습니다 [ 145 ]. 또한 SVCT2 발현에 의존하는 MAPK/ERK 신호 전달에 대한 아스코르브산의 영향도 마우스 신경모세포종 세포에서 발견되었습니다[ 146 ]. SVCT2의 과발현은 N2a 마우스 신경모세포종 세포의 분화된 표현형과 연관되어 있는 것으로 제안되었습니다. SVCT2가 과발현된 신경모세포종 세포에 아스코르브산을 보충하면 MAPK/ERK 인산화가 촉진되어 결국 중추신경계 발달로 이어질 수 있습니다[ 146 ].
7. 결론
비타민 C로 암을 치료할 수 있다는 가능성은 처음부터 논란의 여지가 많은 주제였습니다. 일부 발표된 데이터에서는 암 치료에서 비타민 C의 역할과 암에서의 생체 이용률에 대한 유망한 결과가 나타났습니다. 비타민C의 임상 항암 잠재력은 비타민C와 관련된 수많은 임상 시험에 반영되어 있습니다. 세포 내 비타민C 수준은 비타민C 수송체 발현 및 세포 내 비타민C 다형성과 관련이 있을 수 있습니다. 따라서 두 가지 주요 비타민 C 수송체의 돌연변이는 기능 장애에 기여할 수 있으며 따라서 이 리뷰에서 제안된 것처럼 암 발병에 그럴듯하게 기여할 수 있습니다. SVCT의 다형성, 암 위험 및 발병률 사이의 실제 연관성을 추정하기 위해서는 추가 조사가 필요합니다. 또한, SLC23A1 및 SLC23A2 유전자 의 유전적 다형성 위치에는 인트론과 엑손이 포함됩니다[ 147 ]. 따라서 인트론에 위치한 다형성이 비타민 C 조절에 역할을 하는 이유는 여전히 모호합니다. 유전적 변이가 SVCT 전사 조절에 영향을 미칠 수 있는 것으로 보입니다. Skibola 등에 따르면, in silico 모델에서는 SLC23A2 ( SLC23A2 rs1715364) 의 다형성이 SLC23A2 발현을 증가시켜 결과적으로 비타민 C 생체 이용률을 강화할 수 있음을 나타냅니다[ 136 ]. 비타민C는 암 예방과 치료에 유망한 후보로 보입니다. 그러나 특히 다양한 유형의 암과 암 치료에서 비타민 C 수송체 다형성의 역할에 대한 추가 연구가 여전히 필요합니다.
 젊은 뇌의 비타민 C 결핍—실험 동물 모델을 통한 결과 †
젊은 뇌의 비타민 C 결핍—실험 동물 모델을 통한 결과 †
 시판 제품에 통합된 아스코르빈산의 화학적 안정성: 생체 활성 및...
시판 제품에 통합된 아스코르빈산의 화학적 안정성: 생체 활성 및...